
| A. | 新戊烷 C(CH3)4 | B. | 3-乙基-1-丁烯 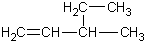 | ||
| C. | 2-甲基-2,4-己二烯 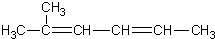 | D. | 2,2,3-三甲基戊烷 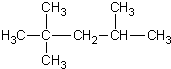 |
分析 A、“正、异、新”是习惯命名法;
B、烯烃命名时,要选含官能团的最长的碳链为主链,从离官能团最近的一端给主链上的碳原子编号,并表示出官能团的位置;
C、二烯烃命名时,要选含官能团的最长的碳链为主链,从离官能团最近的一端给主链上的碳原子编号,并表示出官能团的位置和数目;
D、烷烃命名时,要选最长的碳链为主链,从离支链近的一端给主链上碳原子编号,据此分析;
解答 解:A、“正、异、新”是习惯命名法,不是系统命名法,此烷烃的系统命名法为2,2-二甲基丙烷,故A错误;
B、烯烃命名时,要选含官能团的最长的碳链为主链,故主链上有5个碳原子,从离官能团最近的一端给主链上的碳原子编号,则碳碳双键在1号和2号碳原子之间,在3号碳原子上有一个甲基,故名称为:3-甲基-1-戊烯,故B错误;
C、二烯烃命名时,要选含官能团的最长的碳链为主链,从离官能团最近的一端给主链上的碳原子编号,当两端离官能团一样近时,要从离支链近的一端给主链上的碳原子编号,在2号碳原子上有一个甲基,在2号、3号碳原子之间、4号和5号碳原子之间各有一条双键,故名称为:2-甲基-2,4-己二烯,故C正确;
D、烷烃命名时,要选最长的碳链为主链,故主链上有5个碳原子,从离支链近的一端给主链上碳原子编号,当两端离支链一样近时,要从支链多的一端给主链上的碳原子进行编号,故在2号碳原子上有2个甲基,在4号碳原子上有一个甲基,故名称为:2,2,4=三甲基戊烷,故D错误.
故选C.
点评 本题考查了烯烃、二烯烃和烷烃的命名,较易出错的是A和C,A应注意题干的要求,C应注意二烯烃的表示方法.


科目:高中化学 来源: 题型:多选题
| A. | BaCl2与K2CO3溶液反应 | B. | CO2与Ba(OH)2溶液反应 | ||
| C. | Ba(NO3)2与Na2CO3溶液反应 | D. | Ba(OH)2与少量NaHCO3溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
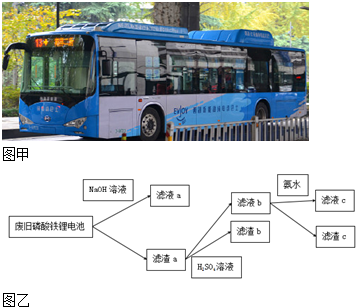
| A. | 向滤液a中加入适量H2SO4溶液,可以得到白色沉淀 | |
| B. | 滤液b中加入氨水的目的是使Fe3+沉淀,滤渣c为红褐色 | |
| C. | 要将Li从溶液中析出,可在滤液c中加入足量Na2CO3溶液,加热浓缩,冷却结晶 | |
| D. | 图中的氨水可以用适量NaOH溶液代替 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在生产生活中,卤族元素(F、Cl、Br、I)的单质及化合物用途广泛.
在生产生活中,卤族元素(F、Cl、Br、I)的单质及化合物用途广泛. ;从HF、HCl混合气体中分离出HF的方法是冷凝.
;从HF、HCl混合气体中分离出HF的方法是冷凝.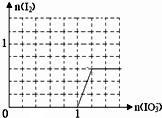 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
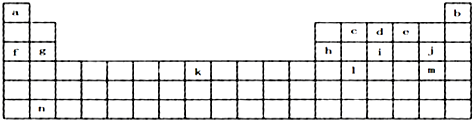
 ,元素c在周期表的位置第二周期IVA族
,元素c在周期表的位置第二周期IVA族查看答案和解析>>
科目:高中化学 来源: 题型:解答题
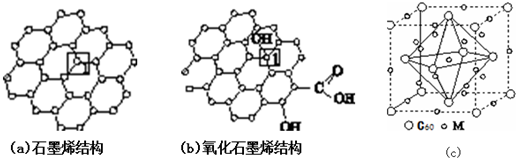
 )是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如图(d)所示,立方烷分子填充在原C60晶体的分子间空隙中.则该复合型分子晶体的组成用二者的分子式可表示为C8H8.C60
)是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如图(d)所示,立方烷分子填充在原C60晶体的分子间空隙中.则该复合型分子晶体的组成用二者的分子式可表示为C8H8.C60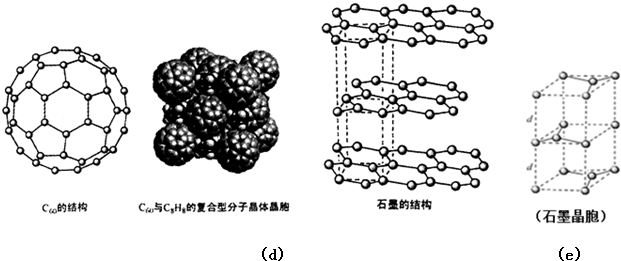
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
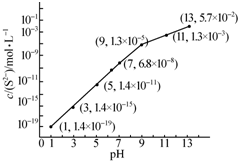 研究硫元素及其化合物的性质具有重要意义.
研究硫元素及其化合物的性质具有重要意义.| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-4 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com