
| A. | Na | B. | Cl | C. | F | D. | Li |
科目:高中化学 来源: 题型:解答题
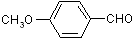 )具有多种同分异构体.
)具有多种同分异构体.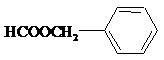 ;②
;②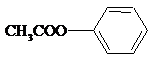 ;③
;③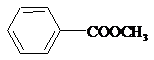 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2、O3 | B. | Na2O、Na2O2 | ||
| C. | ${\;}_{19}^{40}$K、${\;}_{20}^{40}$Ca | D. | 1H、2H、3H |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
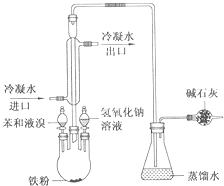 图是实验室制取溴苯的装置图
图是实验室制取溴苯的装置图 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
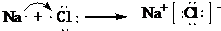
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
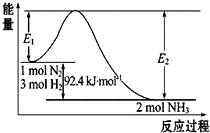 合成氨工业的核心反应是:N2(g)+3H2(g)?2NH3(g)△H=“Q“kJ•mol-1,能量变化如图所示,回答下列问题:
合成氨工业的核心反应是:N2(g)+3H2(g)?2NH3(g)△H=“Q“kJ•mol-1,能量变化如图所示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C3H5Cl的链状同分异构体有4种(考虑顺反异构) | |
| B. | 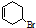 能发生氧化反应、取代反应、加成反应和消去反应 能发生氧化反应、取代反应、加成反应和消去反应 | |
| C. | 分子式符合C4H8O2的酸类和酯类同分异构体共有6种 | |
| D. | 丙烯分子内所有原子都在同一个平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L 0.1mol/L的氨水中有0.1NA个NH4+ | |
| B. | 在标准状况下22.4L SO3有4NA个原子 | |
| C. | 标准状况下,22.4LNO与11.2LO2混合后气体的分子数为2NA | |
| D. | 7.8g Na2S和Na2O2的混合物中所含离子数为0.3 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com