
【题目】某晶体的下列性质可作为判断它是离子晶体的充分依据的是( )
A.具有较高的熔点和较大的硬度
B.固态不导电,其水溶液能导电
C.可溶于水
D.固态不导电,熔融态能导电
科目:高中化学 来源: 题型:
【题目】某课外研究性学习小组拟用粗盐(含有少量杂质包括:泥沙、CaCl2、MgCl2、Na2SO4)经提纯后,配制0.4mol/L 450mL NaCl溶液.他们设计并实施了如下实验,请根据已学过的知识回答下列问题:
(1)取一定量的粗盐置于烧杯中加水溶解,所加的水量应为: . (填选项)
A.多加水配成较稀的溶液
B.加入适量的水至能溶解的固体溶解即止
(2)将(1)中配制的粗盐悬浊液过滤后取滤液加入过量的除杂试剂,如果除杂试剂可从下列六种溶液中选择 ①Na2CO3溶液 ②KOH溶液 ③AgNO3溶液 ④NaOH溶液 ⑤NaHCO3溶液 ⑥BaCl2溶液,则正确的试剂和加入的顺序应为 . (填选项,多选、少选、错选都不得分)
A.①②③B.②⑥⑤C.④⑥①D.①④⑥E.⑥①④F.⑥②⑤
将所得的悬浊液经过滤后取滤液加入足量的盐酸,充分反应后对混合溶液进行蒸发、过滤、洗涤、干燥操作,得到纯净的NaCl固体,请描述在蒸发操作过程中玻璃棒的作用是 .
(3)利用(2)中所得的NaCl固体继续配制所需溶液.在托盘天平上称量g NaCl固体.配制过程中需要使用的玻璃仪器有:烧杯、玻璃棒、和 .
(4)配制结束后同学们对实验中出现的某些错误操作,对最终配制的溶液浓度的影响进行了分析,则下列错误操作会导致最终配制溶液中NaCl的浓度相比0.4mol/L的偏差是:(填“偏大”、“偏小”、“无影响”)
①在上述(2)步中没有使用盐酸处理滤液,结果会 ,
②定容时俯视凹液面,结果会
③上下颠倒摇匀后液面低于刻度线,未及时加水至刻度线,结果会
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化钠是日常生活中常用的调味品。下列性质可以证明氯化钠中一定存在离子键的是
A. 常温下能溶于水 B. 水溶液能导电
C. 熔融状态能导电 D. 具有较高的熔点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关塑料问题的叙述不正确的是
A.塑料是一种人工合成的高分子材料,具有良好的成膜性、绝缘性、耐腐蚀性能特点
B.普通的塑料膜碎片在土壤中很快会被降解
C.废塑料的焚烧会产生大量的污染物
D.塑料的分类是回收和利用的一大障碍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,CaSO4在水中的沉淀溶解平衡曲线如图所示[Ksp(CaSO4)=9×10﹣6].下列说法正确的是( )

A. b点对应的Ksp等于a点对应的Ksp
B. d点溶液通过蒸发可以变到c点
C. b点将有沉淀生成,平衡后溶液中c(SO42﹣)一定等于3×10﹣3 molL﹣1
D. 在任何溶液中,c(Ca2+)、c(SO42﹣)均相等.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关生物体细胞组成元素的叙述,错误的是( )
A. 在不同生物的体细胞内,组成它们的化学元素种类大体相同
B. 组成细胞的最基本元素是C
C. 在同一生物的不同体细胞内,各种化学元素的含量相同
D. 组成生物体细胞的化学元素,在无机自然界中都能找到
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000 mol/L NaOH溶液分别滴定20.00 mL 0.1000 mol/L盐酸和20.00 mL 0.1000 mol/L醋酸溶液,得到2条滴定曲线,如下图所示:
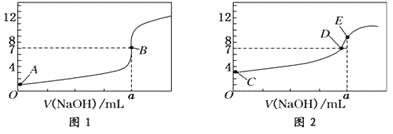
以HA表示酸,下列说法正确的是( )
A. 滴定盐酸的曲线是图2
B. 达到B、D状态时,两溶液中离子浓度均为c(Na+)=c(A—)
C. 达到B、E状态时,反应消耗的n( CH3COOH)>n(HCl)
D. 当0mL< V(NaOH)<20.00mL时,对应混合溶液中各离子浓度由大到小的顺序均为c(A-)>c(Na+)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.硫单质与金属铁反应生成FeS,体现了硫单质的氧化性
B.H2S既具有还原性,又具有氧化性
C.SO2能使酸性KMnO4溶液、氯水褪色,说明SO2具有漂白性。
D.SO2在一定条件下可转化为SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究乙烯与溴的加成反应,甲同学设计并进行了如下实验,将乙醇与浓硫酸的混合液加热至170℃,将生成的气体通入溴水中,发现溴水褪色,即证明乙烯与溴水发生了加成反应.
(1)写出甲同学实验中两个主要的化学方程式_______________;___________;
(2)乙同学在甲同学的实验中发现,生成的气体有刺激性气味,推测产生的气体除乙烯外,还有副产物SO2 和CO2,SO2也能使溴水褪色:SO2+Br2+2H2O→H2SO4+2HBr
于是对甲同学的结论提出质疑;为确认乙烯能使溴水褪色,甲同学在实验时先将混合气体通过足量的_________(填序号)以除去其中的SO2,再通入溴水时发现剩余气体仍能使溴水褪色.
(A)氯水 (B)NaOH溶液 (C)酸性KMnO4溶液
(3)乙同学又提出质疑,认为乙烯使溴水褪色也可能发生了取代反应:CH2=CH2+Br2→CH2=CHBr+HBr
甲同学认为很有道理,于是又做了一个简单的实验来确认是否发生取代反应,该实验所用的试剂是_________,可能的现象和结论是______________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com