
通过下列实验现象的分析,对实验事实的解释正确的是
A.常温下,将铝片放入浓硫酸中,无明显现象,说明铝不与冷的浓硫酸反应
B.用玻璃棒蘸取浓氨水点到红色石蕊试纸上,试纸变蓝色,说明浓氨水呈碱性
C.H2S能与CuSO4溶液反应生成H2SO4,说明氢硫酸的酸性比硫酸强
D.向滴有酚酞的Na2CO3溶液中加入BaCl2溶液,溶液褪色,说明BaCl2有酸性
科目:高中化学 来源:2016届黑龙江省绥化市高三上学期期中测试化学试卷(解析版) 题型:选择题
在相同状况下,一个空瓶,若装满O2称其质量为36 g,若装满CO2称其质量为42 g,若装满A气体,称其质量为52 g,则A的相对分子质量是
A.16 B.32 C.64 D.128
查看答案和解析>>
科目:高中化学 来源:2016届四川省高三上学期第一次月考化学试卷(解析版) 题型:填空题
(12分) HNO2是一种弱酸,且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+。AgNO2是一种难溶于水、易溶于酸的化合物。试回答下列问题:
(1)人体正常的血红蛋白含有Fe2+。若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒。下列叙述
不正确的是________(填序号)。
A.亚硝酸盐被还原
B.维生素C是还原剂
C.维生素C将Fe3+还原为Fe2+
D.亚硝酸盐是还原剂
(2)下列方法中,不能用来区分NaNO2和NaCl的是________(填序号)。
A.测定这两种溶液的pH
B.分别在两种溶液中滴加甲基橙
C.在酸性条件下加入KI—淀粉溶液来区别
D.用AgNO3和HNO3两种试剂来区别
(3)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:_________________________。
(4) Fe与过量稀硫酸反应可以制取FeSO4。若用反应所得的酸性溶液,将Fe2+转化为Fe3+,要求产物纯净,可选用的最佳试剂是________(填序号)。
a.Cl2 b.Fe c.H2O2 d.HNO3
(5)若FeSO4和O2的化学计量数比为2∶1,试配平下列方程式:
FeSO4+K2O2——K2FeO4+K2O+K2SO4+O2↑
(6)高铁酸钾(K2FeO4)是一种新型、高效的绿色水处理剂,在水中发生反应生成氢氧化铁胶体。高铁酸钾作为水处理剂发挥的作用是_____________________。
查看答案和解析>>
科目:高中化学 来源:2016届安徽省皖南八校高三上学期第一次联考化学试卷(解析版) 题型:实验题
莫尔盐[(NH4)2Fe(SO4)2•6H2O]在定量分析中常用作标定高锰酸钾等溶液的标准物质,还用作化学试剂、医药以及用于冶金、电镀等。回答下列问题:
(1)甲组同学按照如图所示的装置,通过实验检验莫尔盐晶体强热时的分解产物。装置C中可观察到的现象是___ _,由此可知莫尔盐晶体分解的产物中有 。装置B的主要作用是 。

(2)乙组同学认为莫尔盐晶体分解的产物中还含有SO3 (g)、SO2 (g)及N2。为进行验证,选用甲组实验中的装置A和下图所示的部分装置进行实验。
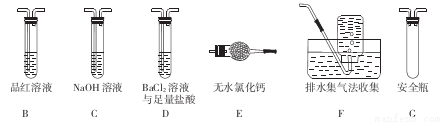
①乙组同学的实验中,装置依次连接的合理顺序为A、___ _。
②装置D中足量盐酸的作用是 ;含有SO3的实验现象是 ;含有SO2的实验现象是_______________________
(3)设计实验证明:
①莫尔盐是否已氧化变质。 。
②莫尔盐可用于标定高锰酸钾溶液的浓度(并写出相应的离子方程式)。 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省泰州市姜堰区高二上学期期中选修化学试卷(解析版) 题型:选择题
在密闭容器中发生反应:aX(g)+bY(g)  cZ(g)+dW(g),反应达到平衡后,保持温度不变,将气体体积压缩到原来的1/2,当再次达到平衡时,W的物质的量浓度为原平衡的1.8倍。下列叙述中不正确的是
cZ(g)+dW(g),反应达到平衡后,保持温度不变,将气体体积压缩到原来的1/2,当再次达到平衡时,W的物质的量浓度为原平衡的1.8倍。下列叙述中不正确的是
A.平衡向逆反应方向移动 B.a + b < c + d
C.Y的体积分数减小 D.X的转化率下降
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省高二上期中测试化学试卷(解析版) 题型:选择题
下列有关物质用途的说法正确的是
A.明矾可用作净水剂 B.甲醛可用作食品防腐剂
C.氢氧化钠可用来治疗胃酸过多 D.铝制容器可长期存放酸性食物
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省高二上第一次月考化学试卷(解析版) 题型:选择题
你认为不正确的是
A.化学反应速率理念可指导怎样在一定时间内快出产品
B.化学平衡理念可指导怎样使用有限原料多出产品
C.化学反应速率理论可指导怎样提高原料的转化率
D.用速率理论和平衡理论都可提高化工生产的综合经济效益
查看答案和解析>>
科目:高中化学 来源:2016届甘肃省高三上学期第一次月考化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数,下列叙述中正确的是
A.14 g乙烯和丙烯的混合物中总原子数为3NA
B.常温下11.2 L甲烷气体含有甲烷分子数为0.5NA
C.5.6 g铁与足量的稀硫酸反应失去电子数为0.3 NA
D.0.1 mol·L-1的氢氧化钠溶液中含钠离子数为0.1NA
查看答案和解析>>
科目:高中化学 来源:2016届浙江省宁波市高三上学期10月月考化学试卷(解析版) 题型:选择题
对于实验I〜IV的描述正确的是

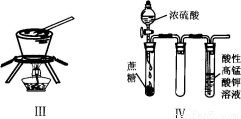
A.实验I :逐滴滴加盐酸时,试管中立即产生大量气泡.
B.实验II:充分振荡后静置,下层溶液为橙红色,上层无色
C.实验III:从饱和食盐水中提取NaCl晶体
D.装置IV:酸性KMnO4溶液中有气泡出现,且溶液颜色会逐渐变浅乃至褪去
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com