
【题目】如图是某有机物分子的简易球棍模型,该有机物中含C,H,O,N四种元素.下列关于该有机物的说法中错误的是( ) 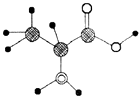
A.分子式为C3H7O2N
B.能发生取代反应
C.能通过聚合反应生成高分子化合物
D.该有机物能跟NaOH溶液反应,但不能和盐酸反应
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列关于元素的叙述正确的是( )
A.金属元素与非金属元素能形成共价化合物
B.只有在原子中,质子数才与核外电子数相等
C.目前使用的元素周期表中,最长的周期含有36种元素
D.非金属元素形成的共价化合物中,原子的最外层电子数只能是2或8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g)ΔH=1269kJ/mol
2N2(g)+6H2O(g)ΔH=1269kJ/mol
②
下列说正确的是
A.断开1 mol O=O键比断开1 mol N≡N键所需能量多448 kJ
B.断开1 mol H―O键比断开1 mol H―N键所需能量相差约72.6 kJ
C.由以上键能的信息可知H2O的沸点比NH3高
D.由元素非金属性的强弱可知 H―O键比H―N键弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.在电解池中,物质在阴极发生氧化反应
B.在电解池中,与电源正极相连的电极是阴极
C.在原电池中,物质在负极发生氧化反应
D.在原电池中,电子由正极流向负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①2K2CrO4+H2SO4![]() K2Cr2O7+K2SO4+H2O
K2Cr2O7+K2SO4+H2O
②K2Cr2O7+6FeSO4+7H2SO4![]() 3Fe2(SO4)3+ Cr2(SO4)3 +K2SO4+7H2O
3Fe2(SO4)3+ Cr2(SO4)3 +K2SO4+7H2O
③Fe2(SO4)3+2HI![]() 2FeSO4+I2+H2SO4
2FeSO4+I2+H2SO4
下列结论正确的是
A.①②③均是氧化还原反应
B.氧化性强弱顺序是K2Cr2O7>Fe2(SO4)3>I2
C.反应②中氧化剂与还原剂的物质的量之比为6∶1
D.反应③中0.1 mol还原剂共失去电子数为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种香料,存在于金橘中,可用如下路线合成: 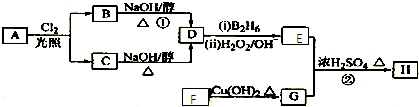
已知:R﹣CH=CH2 ![]() R﹣CH2CH2OH(B2H6为乙硼烷)
R﹣CH2CH2OH(B2H6为乙硼烷)
回答下列问题:
(1)11.2L(标准状况)的烃A在氧气中充分燃烧可以产生88g CO2和45g H2O.A的分子式是
(2)B和C均为一氯代烃,它们的名称(系统命名)分别为
(3)在催化剂存在下1mol F与2mol H2反应,生成3﹣苯基﹣1﹣丙醇.F的结构简式是
(4)反应①的反应类型是;
(5)反应②的化学方程式为
(6)写出所有与G具有相同官能团的G的芳香类同分异构体的结构简式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上冶炼冰铜(mCu2OnFeS)可得到粗铜,冰铜与酸反应可以生成硫化氢(见图1).完成下列填空: 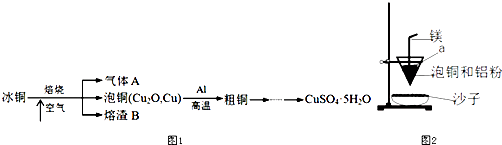
(1)气体A中的大气污染物可选用下列试剂中的(填序号)吸收.
a.浓H2SO4 b.浓HNO3 c.NaOH溶液 d.氨水
(2)实验室可用如图2的装置完成泡铜冶炼粗铜的反应.
①泡铜冶炼粗铜的化学方程式是;
②装置中镁带的作用是;
③泡铜和铝粉混合物表面覆盖少量白色固体a,a是;
(3)将H2S和O2在密闭容器中点燃,充分反应后恢复到原来的温度和压强(120℃、101kPa),气体体积减少30%,求原混合其气体中H2S的体积分数 . (不考虑H2S的自身分解)已知:氧气不足时:2H2S+O2 ![]() 2S+2H2O 氧气足量时:2H2S+3O2═2SO2+2H2O;
2S+2H2O 氧气足量时:2H2S+3O2═2SO2+2H2O;
(4)已知:SiCl4(s)+H2(g)═SiHCl3(s)+HCl(g)△H1=47kJ/mol
SiHCl3(s)+H2(g)═Si(s)+3HCl(g)△H2=189kJ/mol
则由SiCl4制备硅的热化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在NaCl、MgCl2、MgSO4的混合溶液中,c(Na+)=0.10mol/L,c(Mg2+)=0.25mol/L,c(Cl-)=0.20mol/L,则c(SO42-)为
A. 0.10mol/L B. 0.15mol/L C. 0.20mol/L D. 0.25mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)判断下列物质在相应条件下能否电离,并说明理由。
①液态HCl:__________________,理由:_________________________________。
②熔融状态下的NaCl:__________________,理由:_________________________________。
③高温熔化后的单质铁:__________________,理由:_________________________________。
④固体KOH:__________________,理由:________________________________。
(2)写出下列物质在水溶液中的电离方程式。
HCl:____________________________________;
H2SO4:___________________________________________;
Ca(OH)2:_____________________________________________;
KOH:___________________________________________________;
NH4NO3:___________________________________________________;
KAl(SO4)2:_________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com