
分析 (1)根据电子转移守恒及NO和NO2的总物质的量列方程计算NO和NO2的物质的量,再根据V=nVm计算NO体积;
(2)参加反应的硝酸生成Cu(NO3)2、NO、NO2,根据N原子守恒计算参加反应的硝酸的物质的量;
(3)NO、NO2与氧气水又反应生成HNO3,根据电子转移守恒可知,Cu失去的电子等于氧气获得的电子,据此计算氧气物质的量,再根据V=nVm计算.
解答 解:(1)Cu的物质的量为$\frac{96g}{64g/mol}$=1.5mol,NO和NO2总物质的量为$\frac{33.6L}{22.4L/mol}$=1.5mol,
设NO和NO2的物质的量分别为xmol、ymol,则:
$\left\{\begin{array}{l}{x+y=1.5}\\{3x+y=1.5×2}\end{array}\right.$
解得x=y=0.75
故NO的体积为0.75mol×22.4L/mol=16.8L
故答案为:16.8L;
(2)参加反应的硝酸生成Cu(NO3)2、NO、NO2,则n[Cu(NO3)2]=n(Cu)=1.5mol,根据N原子守恒,参加反应的硝酸的物质的量为1.5mol×2+1.5mol=4.5mol,
故答案为:4.5;
(3)NO、NO2与氧气水又反应生成HNO3,根据电子转移守恒可知,Cu失去的电子等于氧气获得的电子,故消耗氧气物质的量为$\frac{1.5mol×2}{4}$=0.75mol,故需要氧气的体积为0.75mol×22.4L/mol=16.8L,
故答案为:16.8.
点评 本题考查化学方程式计算,侧重考查学生分析计算能力,利用守恒法解答避免方程式繁琐,难度中等.


科目:高中化学 来源: 题型:填空题
| 物质 | △H(kJ/mol) |
| CO(g) | -283.0 |
| CH4(g) | -890.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 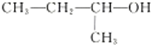 的名称为2-甲基-1-丙醇 的名称为2-甲基-1-丙醇 | |||||||||||||||||
| B. | 按照以下的排布规律,第15项物质可能与金属钠反应
| |||||||||||||||||
| C. | 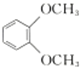 在核磁共振氢谱中出现两组峰,其氢原子个数之比为3:2 在核磁共振氢谱中出现两组峰,其氢原子个数之比为3:2 | |||||||||||||||||
| D. | 甲苯分子内所有原子均在同一平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | p(C2H2)>p(C2H4)>p(C2H) | B. | p(C2H4)>p(C2H)>p(C2H2) | ||
| C. | p(C2H2)>p(C2H)>p(C2H4) | D. | p(C2H)>p(C2H4)>p(C2H2) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com