
ЁОЬтФПЁПЙЄвЕЩЯАбCl2ЭЈШыРфNaOHШмвКжажЦЕУЦЏАзвКЃЈгааЇГЩЗжЮЊNaClOЃЉЁЃФГЛЏбЇаЁзщдквЛЖЈЮТЖШЯТНЋТШЦјЛКЛКЭЈШыNaOHШмвКжаЃЌФЃФтЪЕбщЕУЕНClOЃЁЂClO3ЃЕШРызгЕФЮяжЪЕФСПnЃЈmolЃЉгыЗДгІЪБМфtЃЈminЃЉЕФЙиЯЕЧњЯпЁЃЯТСаЫЕЗЈДэЮѓЕФЪЧ
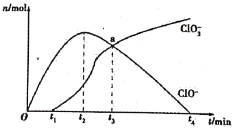
A.ВЮМгЗДгІЫљашNaOHгыТШЦјЕФЮяжЪЕФСПжЎБШвЛЖЈЮЊ2ЃК1
B.aЕуЪБШмвКжаnЃЈNaClЃЉЃКnЃЈNaClO3ЃЉЃКnЃЈNaClOЃЉЃН6ЃК1ЃК1
C.t2ЁЋt4ЃЌClOЃРызгЕФЮяжЪЕФСПЯТНЕЕФдвђПЩФмЪЧ3ClOЃЃН2ClЃЃЋClO3Ѓ
D.ЪЙгУЦЏАзвКЪБЃЌЮЊСЫдіЧПЦЏАзаЇЙћЃЌПЩвдЯђЦЏАзвКжаЭЈШыЖўбѕЛЏСђ
ЁОД№АИЁПD
ЁОНтЮіЁП
AЃЎИљОнШмжЪNaClЁЂNaClOЁЂNaClO3ЃЌХаЖЯNaOHКЭТШЦјжЎМфЕФЙиЯЕЃЛ
BЃЎaЕуЪБn(NaClO3)ЃКn(NaClO)ЃН1ЃК1ЃЌНсКЯЕчзгЪиКуХаЖЯЃЛ
CЃЎгЩЭМПЩжЊЃЌClO3ХЈЖШдіДѓЃЌClOХЈЖШМѕаЁЃЌНсКЯЕчзгзЊвЦЪиКуЃЌПЩФмЪЧClOЗЂЩњЦчЛЏЗДгІЩњГЩClЁЂClO3ЃЛ
DЃЎЖўбѕЛЏСђОпгаЧПЛЙдадЃЌгыЦЏАзвКЗЂЩњбѕЛЏЛЙдЗДгІЁЃ
AЃЎШмвКжаШмжЪЮЊNaClЁЂNaClOЁЂNaClO3ЃЌn(Na)ЃНn(Cl)ЃЌдђВЮМгЗДгІЫљашвЊNaOHгыТШЦјЕФЮяжЪЕФСПжЎБШвЛЖЈЮЊ2ЃК1ЃЌЙЪAе§ШЗЃЛ
BЃЎaЕуЪБЃЌCl2ЭЈШыNaOHШмвКжаЃЌЗДгІЕУЕНКЌгаClOгыClO3ЮяжЪЕФСПжЎБШЮЊ1ЃК1ЕФШмвКЃЌИљОнЕУЪЇЕчзгЪиКуХфЦНЗНГЬЪНЮЊЃК4Cl2ЃЋ8NaOHЃН6NaClЃЋNaClO3ЃЋNaClOЃЋ4H2OЃЌШмвКжаn(NaCl)ЃКn(NaClO3)ЃКn(NaClO)ЃН6ЃК1ЃК1ЃЌЙЪBе§ШЗЃЛ
CЃЎгЩЭМПЩжЊЃЌClO3ХЈЖШдіДѓЃЌClOХЈЖШМѕаЁЃЌНсКЯЕчзгзЊвЦЪиКуЃЌПЩФмЪЧClOЗЂЩњЦчЛЏЗДгІЃК3ClOЃН2ClЃЋClO3ЃЌЙЪCе§ШЗЃЛ
DЃЎЖўбѕЛЏСђОпгаЧПЛЙдадЃЌгыЦЏАзвКЗЂЩњбѕЛЏЛЙдЗДгІЃЌдђПЩвдЯђЦЏАзвКжаЭЈШыЖўбѕЛЏСђЃЌЛсМѕШѕЦЏАзФмСІЃЌЙЪDДэЮѓЃЛ
ЙЪД№АИбЁDЁЃ


 ССЕуМЄЛюОЋБрЬсгХ100ЗжДѓЪдОэЯЕСаД№АИ
ССЕуМЄЛюОЋБрЬсгХ100ЗжДѓЪдОэЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСагаЙиН№ЪєИЏЪДгыЗРЛЄЕФЫЕЗЈе§ШЗЕФЪЧ( )
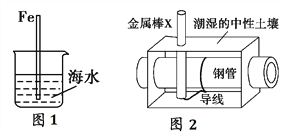
A. ЭМ1жаЃЌВхШыКЃЫЎжаЕФЬњАєЃЌдНППНќЕзЖЫЃЌИЏЪДдНбЯжи
B. ЖЦВуЦЦЫ№КѓЃЌЖЦаПЬњБШЖЦЮ§ЬњИќФЭгУ
C. ДПвјЦїБэУцдкПеЦјжавђЕчЛЏбЇИЏЪДНЅНЅБфАЕ
D. ЭМ2жаЃЌН№ЪєАєXШєЮЊCuЃЌПЩЪЙТёдкЕиЯТЕФИжЙмУтЪмИЏЪД
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвЛЖЈЮТЖШЯТЃЌФГШнЛ§ЮЊ2LЕФУмБеШнЦїФкЃЌФГвЛЗДгІжаMЁЂNЕФЮяжЪЕФСПЫцЗДгІЪБМфБфЛЏЕФЧњЯпШчЭМЫљЪОЃК
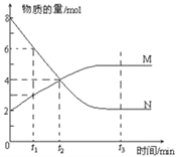
(1)ИУЗДгІЕФЛЏбЇЗНГЬЪНЪЧ_____________________________
(2)дкЭМЩЯЫљЪОЕФШ§ИіЪБПЬжа___________(Ьюt1ЁЂt2Лђt3)ЪБПЬДІгкЦНКтзДЬЌЃЌДЫЪБvе§________vФц(ЬюЃОЁЂЃМЛђ=)ЃЛДяЕНЦНКтзДЬЌКѓЃЌЦНОљЗДгІЫйТЪv(N)ЃКv(M)=___________
(3)ШєЗДгІШнЦїЕФШнЛ§ВЛБфЃЌдђЁАбЙЧПВЛдйИФБфЁБ_________(ЬюЁАФмЁБЛђЁАВЛФмЁБ)зїЮЊИУЗДгІвбДяЕНЦНКтзДЬЌЕФХаЖЯвРОнЁЃ
(4)вбжЊMЁЂNОљЮЊЦјЬхЃЌдђЯТСаДыЪЉФмдіДѓЗДгІЫйТЪЕФЪЧ________(бЁЬюзжФИ) AЃЎЩ§ИпЮТЖШ BЃЎНЕЕЭбЙЧП CЃЎМѕаЁMЕФХЈЖШ DЃЎНЋЗДгІШнЦїЬхЛ§ЫѕаЁ
(5)ЯђвЛИіШнЛ§ЮЊ4LЕФУмБеШнЦїжаГфШы7molSO2КЭ4molO2ЃЌдквЛЖЈЮТЖШКЭбЙЧПЯТЃЌЗЂЩњШчЯТЗДгІЃК2SO2(g)+O22SO3(g)ЃЌО4sКѓДяЕНЦНКтзДЬЌЃЌВтЕУSO2ЕФЮяжЪЕФСПЪЧ3molЃЌдђвдO2БэЪОЕФЗДгІЫйТЪЮЊ________ЃЛЦНКтЪБSO3ЕФЮяжЪЕФСПХЈЖШ________
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП1 mol HЁЊHМќЕФМќФмЪЧ436kJЃЌ1 mol IЁЊIМќЕФМќФмЪЧ151kJЃЌ1 mol HЁЊIМќЕФМќФмЪЧ299kJЃЌдђЖдЗДгІH2ЃЈgЃЉ+I2ЃЈgЃЉ![]() 2HIЃЈgЃЉЕФЫЕЗЈЃЌВЛе§ШЗЕФЪЧ ЃЈ ЃЉ
2HIЃЈgЃЉЕФЫЕЗЈЃЌВЛе§ШЗЕФЪЧ ЃЈ ЃЉ
A.ЗХШШЗДгІB.ЮќШШЗДгІC.ЛЏКЯЗДгІD.ПЩФцЗДгІ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдк2LЕФУмБеШнЦїжаЃЌЗЂЩњвдЯТЗДгІЃК2A(g)ЃЋB(g) ![]() 2C(g)ЃЋD(g)ЁЃШєзюГѕМгШыЕФAКЭBЖМЪЧ8 molЃЌдкЧА10УыжгAЕФЦНОљЗДгІЫйТЪЮЊ0.12 mol/(Ls)ЃЌдђ10УыжгЪБЃЌШнЦїжаBЕФЮяжЪЕФСПЪЧ
2C(g)ЃЋD(g)ЁЃШєзюГѕМгШыЕФAКЭBЖМЪЧ8 molЃЌдкЧА10УыжгAЕФЦНОљЗДгІЫйТЪЮЊ0.12 mol/(Ls)ЃЌдђ10УыжгЪБЃЌШнЦїжаBЕФЮяжЪЕФСПЪЧ
A.5.6 molB.6.8 molC.2.4 molD.3.2 mol
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПCuClЙуЗКгІгУгкЛЏЙЄКЭгЁШОЕШаавЕЁЃФГбаОПадбЇЯАаЁзщФтШШЗжНтCuCl2ЁЄ2H2OжЦБИCuClЃЌВЂНјааЯрЙиЬНОПЁЃ
ИУаЁзщгУЯТЭМЫљЪОзАжУНјааЪЕбщЃЈМаГжвЧЦїТдЃЉ
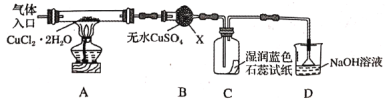
вбжЊЪЕбщВйзїЕФВНжшЮЊЃКa.МьВщзАжУЕФЦјУмадКѓМгШывЉЦЗЁњb.дкЁАЦјЬхШыПкЁБДІЭЈШыИЩдяHClЁњc.ЕуШМОЦОЋЕЦЃЌМгШШЁњd.ЗДгІвЛЖЮЪБМфЃЌЯЈУ№ОЦОЋЕЦЃЌРфШДЁњe.ЭЃжЙЭЈШыHClЃЌШЛКѓЭЈШыN2
ЃЈзЪСЯВщдФЃЉ![]()
ЧыЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉвЧЦїXЕФУћГЦЪЧ___________ЁЃ
ЃЈ2ЃЉдкЪЕбщЙ§ГЬжаЃЌЙлВьЕНBжаЮяжЪгЩАзЩЋБфЮЊРЖЩЋЃЌCжаЪджНЕФбеЩЋБфЛЏЪЧ___________ЁЃ
ЃЈ3ЃЉЗДгІНсЪјКѓЃЌШЁГіCuClВњЦЗНјааЪЕбщЃЌЗЂЯжЦфжаКЌгаЩйСПЕФCuCl2ЛђCuOдгжЪЁЃИљОнзЪСЯаХЯЂ
ЂйШєдгжЪЪЧCuCl2ЃЌдђВњЩњЕФдвђЪЧ_______________ЁЃ
ЂкШєдгжЪЪЧCuOЃЌдђВњЩњЕФдвђЪЧ___________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвбжЊЯЁШмвКжаЂйH+(aq)+OH-(aq)![]() H2O(l) ЁїH1=-57.3kJЁЄmol-1ЃЛ
H2O(l) ЁїH1=-57.3kJЁЄmol-1ЃЛ
Ђк![]() Ba(OH)2(aq)+
Ba(OH)2(aq)+ ![]() H2SO4(aq)=
H2SO4(aq)=![]() BaSO4(s)+H2O(l) ЁїH2ЯТСаНсТле§ШЗЕФЪЧ
BaSO4(s)+H2O(l) ЁїH2ЯТСаНсТле§ШЗЕФЪЧ
A.жаКЭЗДгІЕФЁїH=-57.3kJmol-1B.ЁїH2<ЁїH1
C.ЁїH2>ЁїH1D.жаКЭШШЕФЪ§жЕгыЪЕМЪЗЂЩњЗДгІЕФЫсМюСПгаЙи
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПШмвКXжаКЌгаЯТБэРызгжаЕФФГ5жжЃЌЧвЦфХЈЖШОљЮЊ0.1 molЁЄL1ЃЈВЛПМТЧЫЎЕФЕчРыгыРызгЫЎНтЃЉЁЃЯђXШмвКжаМгШызуСПЯЁбЮЫсЃЌгаЮоЩЋЦјЬхЩњГЩЃЌОЗжЮіЃЌЗДгІЧАКѓвѕРызгжжРрУЛгаБфЛЏЁЃЯТСаа№ЪіВЛе§ШЗЕФЪЧЃЈ ЃЉ
бєРызг | вѕРызг |
Na+ЁЂFe3+ЁЂFe2+ЁЂMg2+ | NO3ЃЁЂHCO3ЃЁЂCO32ЃЁЂSO42ЃЁЂClЃ |
A.XШмвКжавЛЖЈКЌFe3+ЁЂFe2+
B.XШмвКжаВЛПЩФмКЌгаHCO3ЃЛђCO32Ѓ
C.ЩњГЩЮоЩЋЦјЬхЕФРызгЗНГЬЪНЮЊЃК3Fe2+ +NO3Ѓ+4H+===3Fe3++NO Ёќ +2H2O
D.ИљОнЕчКЩЪиКуЃЌдШмвКжавЛЖЈКЌMg2+
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаШШЛЏбЇЗНГЬЪНжаЃЌе§ШЗЕФЪЧЃЈ ЃЉ
A.МзЭщЕФШМЩеШШЮЊ890.3kJЁЄmol-1ЃЌдђМзЭщШМЩеЕФШШЛЏбЇЗНГЬЪНПЩБэЪОЮЊЃКCH4ЃЈgЃЉ+2O2ЃЈgЃЉ=CO2ЃЈgЃЉ+2H2O(g) ЁїH=-890.3kJЁЄmol-1
B.500ЁцЁЂ30MPaЯТЃЌНЋ 0.5molN2ЃЈgЃЉКЭ1.5molH2ЃЈgЃЉжУгкУмБеШнЦїжаГфЗжЗДгІЩњГЩ NH3ЃЈgЃЉЗХШШ19.3kJЃЌЦфШШЛЏбЇЗНГЬЪНЮЊЃКN2ЃЈgЃЉ+3H2ЃЈgЃЉ![]() 2NH3ЃЈgЃЉ ЁїH = -38.6kJЁЄmol-1
2NH3ЃЈgЃЉ ЁїH = -38.6kJЁЄmol-1
C.HCl КЭ NaOH ЗДгІЕФжаКЭШШЁїH=-57.3 kJЁЄmol-1 ЃЌдђH2SO4КЭBaЃЈOHЃЉ2ЗДгІЕФжаКЭШШ ЁїH = 2ЁСЃЈ-57.3ЃЉkJЁЄmol -1
D.дк101kPa ЪБЃЌ2gH2ЭъШЋШМЩеЩњГЩвКЬЌЫЎЃЌЗХГі285.8kJШШСПЃЌЧтЦјШМЩеЕФШШЛЏбЇЗНГЬЪНБэЪОЮЊ2H2(g)+O2(g)=2H2O(1) ЁїH =-571.6 kJЁЄmol-1
ВщПДД№АИКЭНтЮі>>
АйЖШжТаХ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com