
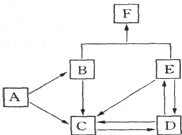
 如图是某元素及其重要化合物之间的相互转化关系图(生成物中不含该元素的物质均已略去).其中A是单质,D在常温下呈气态,F可用作氮肥.
如图是某元素及其重要化合物之间的相互转化关系图(生成物中不含该元素的物质均已略去).其中A是单质,D在常温下呈气态,F可用作氮肥.
| ||
| △ |
| ||
| △ |
| ||
| △ |
| ||
| △ |


科目:高中化学 来源: 题型:阅读理解
 氮是地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.
氮是地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.| 1 |
| 2 |
| 3 |
| 2 |
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
| C4(NO)C6(H2O) |
| C4(NH3)C5(O2) |
| C4(NO)C6(H2O) |
| C4(NH3)C5(O2) |
| 催化剂 |
| 高温高压 |
| 容器 编号 |
起始时各物质的物质的量/mol | 反应达平衡时的焓变/kJ?mol-1 | ||
| N2 | H2 | NH3 | ||
| A | 1 | 3 | 0 | △H1=-23.1 |
| B | 0.9 | 2.7 | 0.2 | △H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| ||
| (一定条件) |
 2NH3(g),△H<0,其化学平衡常数K与t的关系如下表:(已知K=
2NH3(g),△H<0,其化学平衡常数K与t的关系如下表:(已知K=| C(N2)?[C (H2) ]3 |
| [C (NH3)]2 |
| t/K | 298 | 398 | 498 | … |
| K/(mol?L-1)-2 | 4.1×106 | K1 | K2 | … |
查看答案和解析>>
科目:高中化学 来源:浙江省模拟题 题型:填空题
 2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题
2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题 
 2SO3(g)的△H________0(填“>”或“”“<”),若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡________移动(填“向左”“向右”或“不移动”)
2SO3(g)的△H________0(填“>”或“”“<”),若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡________移动(填“向左”“向右”或“不移动”)  _____
_____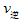 (填“>”“<”或“=”)
(填“>”“<”或“=”)

查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省济宁市高二(上)期末化学试卷(解析版) 题型:解答题
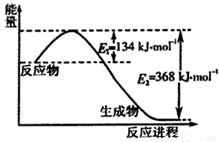
 O2(g)=CO2(g)的△H=______kJ?mol-1
O2(g)=CO2(g)的△H=______kJ?mol-1 O2(g)△H=a kJ?mol-1
O2(g)△H=a kJ?mol-1| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
 2NH3(g)△H=-92.4kJ?mol-1,实验测得反应起始时、达到平衡时的有关数据如下表所示:
2NH3(g)△H=-92.4kJ?mol-1,实验测得反应起始时、达到平衡时的有关数据如下表所示:| 容器 编号 | 起始时各物质的物质的量/mol | 反应达平衡时的焓变/kJ?mol-1 | ||
| N2 | H2 | NH3 | ||
| A | 1 | 3 | △H1=-23.1 | |
| B | 0.9 | 2.7 | 0.2 | △H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com