
| A. | 浓度最大的离子是Na+ | B. | 溶液显酸性 | ||
| C. | c(K+)=0.05mol/L | D. | 阴离子种类多于阳离子 |
分析 根据电荷守恒,原溶液中钾离子的浓度为:0.1mol/L×(1+1+1+2)=0.5mol/L;设溶液体积都是1L,则钾离子为0.5mol,I-、NO3-、AlO2-、SO32-的物质的量各为0.1mol,硫酸氢钠的物质的量为1mol;亚硫酸根离子的还原性大于碘离子,优先反应:3SO32-+2H++2NO3-=2NO↑+H2O+3SO42-,0.1mol亚硫酸根离子消耗$\frac{0.2}{3}$molH+、$\frac{0.2}{3}$molNO3-,剩余的$\frac{0.1}{3}$mol硝酸根离子发生反应:6I-+8H++2NO3-=2NO↑+4H2O+3I2,碘离子恰好被氧化成碘单质,同时消耗$\frac{0.4}{3}$mol氢离子;0.1mol偏铝酸根离子完全反应转化成铝离子消耗0.4mol氢离子,总共消耗的氢离子的物质的量为:$\frac{0.2}{3}$mol+$\frac{0.4}{3}$mol+0.4mol=0.6mol<1mol,所以反应后氢离子有剩余,溶液显示酸性;
反应后钠离子仍然为1mol,而硫酸根离子为1.1mol,所以硫酸根离子浓度最大;
反应后溶液体积最大一倍,则钾离子浓度为0.25mol/L;
反应后的阳离子为:铝离子、钠离子、钾离子、氢离子,阴离子为:氢氧根离子、硫酸根离子,反应后阳离子种类多,根据以上分析对各选项进行判断.
解答 解:根据电荷守恒,原溶液中钾离子的浓度为0.1mol/L×(1+1+1+2)=0.5mol/L;
设溶液体积都是1L,则钾离子为0.5mol,I-、NO3-、AlO2-、SO32-的物质的量都各为0.1mol,硫酸氢钠的物质的量为1mol;
由于SO32-的还原性大于I-,SO32-优先被氧化:3SO32-+2H++2NO3-=2NO↑+H2O+3SO42-,0.1molSO32-消耗$\frac{0.2}{3}$molH+、$\frac{0.2}{3}$molNO3-,剩余的$\frac{0.1}{3}$mol硝酸根离子发生反应:6I-+8H++2NO3-=2NO↑+4H2O+3I2,0.1molI-离子完全反应消耗$\frac{0.1}{3}$mol硝酸根离子,说明硝酸根离子和碘离子恰好反应,同时消耗$\frac{0.4}{3}$mol氢离子;0.1mol偏铝酸根离子完全反应转化成铝离子消耗0.4mol氢离子,
所以总共消耗的氢离子的物质的量为:$\frac{0.2}{3}$mol+$\frac{0.4}{3}$mol+0.4mol=0.6mol<1mol,所以反应后H+有剩余,溶液显示酸性;
A.反应后Na+仍然为1mol,而SO42-为:1mol+0.1mol=1.1mol,所以SO42-离子浓度最大,故A错误;
B.根据分析可知,反应后氢离子过量,溶液显示酸性,故B正确;
C.反应后溶液体积最大一倍,则钾离子浓度为减小一半,为0.25mol/L,故C错误;
D.反应后的阳离子有:Al3+、Na+、K+、H+,阴离子有:OH-、SO42-,故反应后阳离子种类多,故D错误;
故选B.
点评 本题考查了氧化还原反应的计算,题目难度较大,明确发生反应的原理及过量情况为解答关键,试题计算量较大,充分考查了学生的分析、理解能力,选项AC为易错点,需要明确反应中生成的硫酸根离子、C注意反应后溶液体积增大一倍.


科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 向浓度为0.1mol•L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水 | 先出现蓝色沉淀 | Ksp[Mg(OH)2]>Ksp[Cu(OH)2] |
| B | 溴乙烷与NaOH溶液共热后,滴加AgNO3溶液 | 未出现淡黄色沉淀 | 溴乙烷未水解 |
| C | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈红色 | 原溶液中不含K+ |
| D | 某盐溶于盐酸,产生无色无味气体通入澄清石灰水 | 变浑浊 | 说明该盐是碳酸盐 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池工作时消耗5.6LO2,转移电子为1mol | |
| B. | 检测时,电解质溶液中的H+向负极移动 | |
| C. | 正极上发生的反应为:O2+4e-+2H2O=4OH- | |
| D. | 负极上发生的反应为:CH3CH2OH-4e-+H2O=CH3COOH+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 装置 | 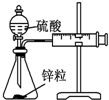 | 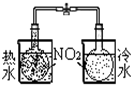 | 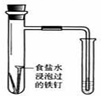 | 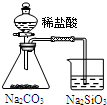 |
| 实验 | 结合秒表定量比较锌与不同浓度的稀硫酸反应的快慢 | 证明温度对化学平衡的影响 | 验证铁钉发生吸氧腐蚀 | 可证明非金属性Cl>C>Si |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  如图所示,集气瓶内充满Cl2和CH4的混合气体或NO2和O2的混合气体,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,并可能充满集气瓶 | |
| B. | 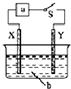 如图所示,X为铁棒,Y为铜棒,a为直流电源,当S闭合后,当b为NaOH溶液,X极附近产生白色沉淀时,电子从X极流入a | |
| C. | 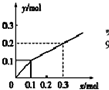 Pt为电极,电解含0.10 mol M+和0.1 mol N3+(M+、N3+均为金属阳离子)的溶液,阴极析出金属单质或气体的总物质的量(y)与导线中通过电子的物质的量(x)的关系如图,离子氧化能力M+>N3+>H+ | |
| D. | 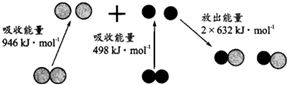 如图为N2(g)和O2(g)生成NO(g)过程中的能量变化,则N≡N的键能为946kJ/mol,热化学方程式为:N2(g)+O2(g)═2NO(g)△H=-180 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 节日燃放焰火,其颜色是某些金属元素焰色反应所致 | |
| B. | 糖类、蛋白质、油脂等营养物质都属于天然高分子化合物 | |
| C. | “温室效应”、“酸雨”、“光合作用”等现象都与CO2有关 | |
| D. | 浸泡过高锰酸钾溶液的硅藻土放于新鲜的水果箱内是为了催熟水果 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以焦炭和铁矿石为原料炼铁的原理是用焦炭直接还原化合态的铁 | |
| B. | 据报道,庐江磁性材料产生“磁”力无穷,磁性氧化铁的化学式是Fe2O3 | |
| C. | 为证明某铁矿石中存在铁离子,可将铁矿石溶于硝酸后,再加KSCN溶液 | |
| D. | 利用铁矿石制得的能除去污水中的,可知相同条件下,Ksp(FeS)>Ksp(HgS) |
查看答案和解析>>
科目:高中化学 来源:2017届湖南省长沙市高三上学期第13次周测理科综合化学试卷 题型:简答题
研究CO2与CH4反应转化为CO和H2,对减缓燃料危机、减少温室效应具有重要的意义。
(1)已知:①2CO(g)+O2(g)=2CO2(g) △H=-566 kJ·mol-1②2H2(g)+O2(g)=2H2O(g) △H=-484kJ·mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890kJ·mol-1则CH4(g)+CO2(g)= 2CO(g)+2H2(g)△H=___kJ·mol-1。
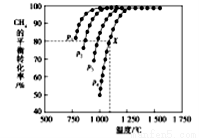
(2)在密闭容器中通入物质的量浓度均为nmol的CH4与CO2,在一定条件下发生反应CH4(g)+CO2(g)= 2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如下图所示。
①下列事实能说明该反应一定达到平衡的是____。
a.CO2的浓度不在发生变化
b.V(CH4)=2v(CO)
c.混合气体的平均相对分子质量不发生变化
d.CO与H2的物质的量比为1:1
②据图可知,P1、P2、P3、P4由大到小的顺序位______,理由是____。
③在压强为P4、1100℃的条件下,用n和P4列式计算X电平衡常数Kp=____(用平衡分压代替平衡浓度计算,分压=总压*物质的量分数)。
(3)工业上可用CO2与NH3合成制尿素的原料氨基甲酸铵(NH2COONH4)。氨基甲酸铵极易发生反应:NH2COONH4+2H2O NH4HCO3+NH3·H2O,该反应在酸性条件下进行得更彻底。25℃时,向1L0.1molL-1的盐酸中逐渐加入氨基甲酸铵粉末至溶液呈中性(忽略溶液体积变化),共用去0.052mol氨基甲酸铵。若此时溶液几乎不含碳元素,则该溶液中c(NH4+)=____,NH4+水解平衡常数KA=____。
NH4HCO3+NH3·H2O,该反应在酸性条件下进行得更彻底。25℃时,向1L0.1molL-1的盐酸中逐渐加入氨基甲酸铵粉末至溶液呈中性(忽略溶液体积变化),共用去0.052mol氨基甲酸铵。若此时溶液几乎不含碳元素,则该溶液中c(NH4+)=____,NH4+水解平衡常数KA=____。
(4)控制溶液PH为9-10,用漂白粉可除去CN-、CI-废水中的CN-,CN-被氧化为两种无污染的气体,写出该反应的离子方程式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com