
| A、若混合溶液的pH>7,则一定有c1?V1≥c2?V2 |
| B、若V1=V2,c1=c2,则混合液中c(NH+4)>c(Cl-) |
| C、若混合液的 pH=7,则混合液中c(NH4+)=c(Cl-) |
| D、若V1=V2,且混合液的pH<7,则一定有c1<c2 |


科目:高中化学 来源: 题型:
| A、等于10 s |
| B、等于12 s |
| C、大于12 s |
| D、小于12 s |
查看答案和解析>>
科目:高中化学 来源: 题型:
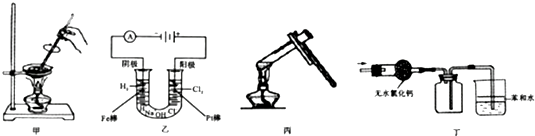
| A、装置甲可用于蒸干NH4Cl饱和溶液制备NH4Cl |
| B、装置乙可用于实验室制备少量氢气、氯气等 |
| C、装置丙可用于实验室检验麦芽糖中是否含有醛基 |
| D、装置丁可用于实验室干燥并收集氨气,同时进行尾气处理,防止污染大气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、白铁(镀锌铁)镀层破损后,先被腐蚀的是铁 |
| B、锌跟稀硫酸反应制取氢气,加入少量硫酸铜溶液能加快反应速率 |
| C、钢铁表面常易锈蚀生成Fe2O3?nH2O |
| D、金属的腐蚀主要是电化学腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、50×18×6.02×1023 |
| B、6.02×1023/50 |
| C、6.02×1023/50×18 |
| D、50×6.02×1023/18 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、苹果是酸性食物 |
| B、猪肉、牛肉是碱性食物 |
| C、大米、面包是碱性食物 |
| D、巧克力、奶油是酸性食物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
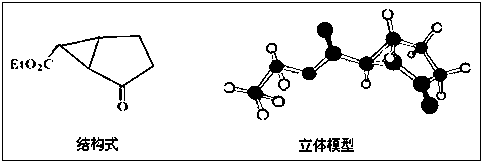
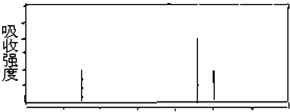
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
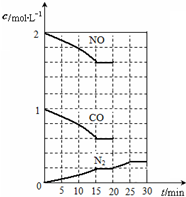 降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:
降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com