
【题目】下列离子方程式表达正确的是
A. 用惰性电极电解氯化镁溶液:2Cl-+2H2O![]() Cl2↑+H2↑+OH-
Cl2↑+H2↑+OH-
B. 碳酸氢钠溶液与过量澄清石灰反应:HCO3-+Ca2++OH-= CaCO3↓+ H2O
C. NaHS04溶液中滴入Ba(OH)2溶液至S042-完全沉淀:2H++S042-+Ba2++ OH-= BaS04↓+2 H2O
D. 向明矾溶液中滴加过量氨水:Al3++4NH3![]() H2O=Al02-+4NH4++2H2O
H2O=Al02-+4NH4++2H2O
 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】下列解释事实的方程式正确的是( )
A. 用CuCl2溶液做导电实验,灯泡发光:CuCl2![]() Cu2++2Cl﹣
Cu2++2Cl﹣
B. 铅蓄电池放电时,负极增重:Pb﹣2e﹣+SO42﹣=PbSO4
C. 向碳酸钠溶液中滴加酚酞时,溶液变红:CO32﹣+2H2OH2CO3+2OH﹣
D. 明矾可用于净水:Al3++3H2OAl(OH)3↓+3H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是
A. 12.4gP4中所含共用电子对总数为0.4NA
B. 25℃时,pH=l的HC1溶液中含有H+的数目为0.1NA
C. 标准状况下,19gH218O2中所含电子总数为9NA
D. 1molSO2与0.5molO2在容积为V的容器中充分反应后转移电子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向氧化铁、氧化铜、铁、铜的混和粉末中加入过量的稀盐酸,充分反应后,仍有红色粉末存在,则关于溶液中阳离子的判断正确的是( )
A.只有Fe2+和Cu2+B.一定有Fe2+、Cu2+,可能有Fe3+
C.一定有Fe2+,可能有Cu2+D.只有Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100ml0.25molL﹣1 AlCl3溶液中,Cl﹣的物质的量浓度为molL﹣1;若将上述溶液加水稀释到500ml,Cl﹣的物质的量浓度为molL﹣1 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、实验室要配制物质的量浓度为0.1 mol/L的NaOH溶液480 mL
(1)填表:
配制时应称量NaOH的质量/g | 已给仪器 | 配制时除已给仪器外还需要的其他仪器 |
__________ | 烧杯、药匙、托盘天平 | ____________________________ |
(2)若要计算该溶液溶质的质量分数,还需要的一个条件是______________(用文字说明)。
(3)下列操作对配制的NaOH溶液浓度有偏高影响的是_________________(填字母)
A.称量NaOH固体时,露置在空气的时间过长
B.选用的容量瓶内有少量的蒸馏水
C.在烧杯中溶解NaOH后,立即将所得溶液注入容量瓶中
D.在定容时仰视容量瓶刻度线
Ⅱ、实验室用下图几个实验装置,可快速制取少量气体,并进行相关性质实验。

(1)若 A为30%H2O2溶液,B为MnO2 ,C盛有氢硫酸(H2S)饱和溶液,旋开E后,C中出现浅黄色浑浊的现象,写出C中发生反应的化学方程式:______________________________________。
(2)若A中装有浓盐酸,B中装有固体KMnO4 ,C中盛有KI淀粉溶液,旋开E后,B中出现黄绿色气体。已知1 mol KMnO4发生反应时转移5mol电子。则B中发生反应的离子方程式是:_______;C中的现象是:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关图示说法不正确的是( )
![]()
![]()
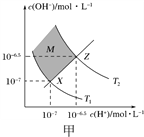
A. 图甲表示水中c(H+)和c(OH-)的关系,则XZ线上任意点均表示溶液呈中性
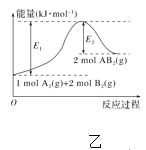
B. 图乙表示由2 mol A(g)和4 mol B(g)形成4 mol A—B键放出E2 kJ能量
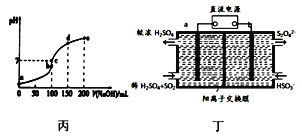
C. 25℃时向l00mL0.1mol/L NH4HSO4溶液中滴加0.lmol/L NaOH溶液的pH与NaOH溶液体积关系曲线如图丙,则a点到b点过程中,溶液导电能力增强
D. 图丁装置(电极均为惰性电极)可吸收SO2,其阴极反应式为2HSO3-+2e-+2H+=S2O42-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3是一种重要的化工原料。
(1)不同温度、压强下.合破氦平衡休系NH3的物质的量分数如图(N2和H2的起始物质的量之比为1:3)。
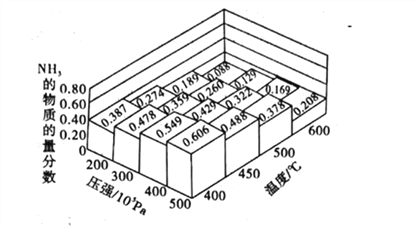
①分析图中数据,升商温度,该反应的平衡常数K值____(填“增大”“城小”或“不变”)。
②下列关于合成氨的说法正确是_____(填序号)。
A.工业上合成氨,为了提高氨的含量压强越大越好
B.使用催化剂可以提高氨气的产率
C.合成氨反应△H<0、△S<0,该反应高温条件下一定能自发进行
D.减小n(N2):n(H2)的比值,有利于提高N2的转化率
③如果开始时向密闭容器中投入1.0molN2和3.0molH2,则在500C、3×107Pa条件下达到平衡时N2的平衡转化率=_______。(保留两位有效数字)
(2)以氨气代替氢气研发氨燃料电池是当前科研的一一个热点。氨燃料电池使用的电解质溶液是KOH溶液。该电池负极的电极反应式为_________________。
(3)NH3也是造成水体富营养化的重要因素之一,用次氯酸钠水解生成的次氯酸将水中的NH3转化为氮气除去,其相关反应的热化学方程式如下:
反应I:NH3 (aq)+HClO(aq)=NH2Cl(aq)+H2O(l) △H1=akJ/mol;
反应II:NH2Cl(aq)+HClO(aq)=NHCl(aq)v △H2=bkJ/mol;
反应III:2NHCl2(aq)+H2O(l)=N2(g)+HClO(aq)+3HCl(aq) △H3=ckJ/mol。
①2NH3(aq)+3HClO(aq)==N2(g)+ H2O(l) △H=________kJ/mol
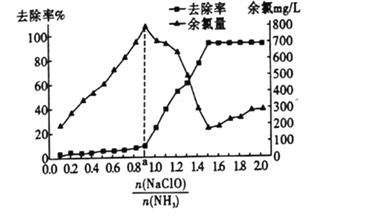
②已知在水溶液中NH2Cl较稳定,NHCl2不稳定易转化为氮气。在其他条件不变的情况下,改变![]() 对溶液中次氯酸钠去氨氮效果与余氯(溶液中+1价氯元素的含量)的影响如图l4所示。a点之前溶液中发生的主要反应为_______(填序号)。
对溶液中次氯酸钠去氨氮效果与余氯(溶液中+1价氯元素的含量)的影响如图l4所示。a点之前溶液中发生的主要反应为_______(填序号)。
A.反应I、I I B.反应I
③除氨氮过程中最佳的![]() 值约为______________。
值约为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com