
(9分)A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系:
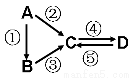
(1)若A是淡黄色固体,C、D是氧化物,且C是造成酸雨的主要物质。写出其中D与水反应生成的酸名称 。
(2)若B是气态氢化物。C、D是氧化物且会造成光化学烟雾污染。写出③反应的化学方程式 。
(3)若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体。写出④反应离子方程式 。
(4)若A是太阳能电池用的光伏材料。C、D为钠盐,两种物质中钠、氧外的元素为同一主族,且溶液均显碱性。写出②反应的化学方程式 。
(5)若A是应用最广泛的金属。④反应用到A,②⑤反应均用到同一种非金属单质。写出④反应的离子方程式 。
(9分)(1)硫酸 ;(2)4NH3+5O2 4NO+6H2O; (3)AlO+CO2+2H2O=Al(OH)3↓+HCO
4NO+6H2O; (3)AlO+CO2+2H2O=Al(OH)3↓+HCO
(4) Si+2NaOH+2H2O=Na2SiO3+2H2↑;(5)2Fe3++Fe=3Fe2+。
【解析】
试题分析:(1)若A是淡黄色固体,C、D是氧化物,且C是造成酸雨的主要物质。则A是S,B是H2S,C是SO2,D是SO3。则SO3与水反应生成硫酸,(2)若B是气态氢化物。C、D是氧化物且会造成光化学烟雾污染。则A是N2,B是NH3,C是NO,D是NO2。则SO3与水反应生成硫酸,③反应的化学方程式是4NH3+5O2 4NO+6H2O; (3)若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体。则A是Al,B是Al2O3,C是NaAlO2,D是Al(OH)3。④反应离子方程式是AlO+CO2+2H2O=Al(OH)3↓+HCO;(4)若A是太阳能电池用的光伏材料。C、D为钠盐,两种物质中钠、氧外的元素为同一主族,且溶液均显碱性。则A是Si,B是SiO2,C是Na2SiO3,D是Na2CO3。②反应的化学方程式是Si+2NaOH+2H2O=Na2SiO3+2H2↑; (5)若A是应用最广泛的金属。④反应用到A,②⑤反应均用到同一种非金属单质。则A是Fe,B是Fe3O4,C是FeCl3,D是FeCl2。④反应的离子方程式是2Fe3++Fe=3Fe2+。
4NO+6H2O; (3)若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体。则A是Al,B是Al2O3,C是NaAlO2,D是Al(OH)3。④反应离子方程式是AlO+CO2+2H2O=Al(OH)3↓+HCO;(4)若A是太阳能电池用的光伏材料。C、D为钠盐,两种物质中钠、氧外的元素为同一主族,且溶液均显碱性。则A是Si,B是SiO2,C是Na2SiO3,D是Na2CO3。②反应的化学方程式是Si+2NaOH+2H2O=Na2SiO3+2H2↑; (5)若A是应用最广泛的金属。④反应用到A,②⑤反应均用到同一种非金属单质。则A是Fe,B是Fe3O4,C是FeCl3,D是FeCl2。④反应的离子方程式是2Fe3++Fe=3Fe2+。
考点:考查元素及化合物的性质、相互转化、化学方程式的书写的知识。


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源:2015届浙江省温州市十校联合体高三上学期期中联考化学试卷(解析版) 题型:选择题
已知反应X (g) + Y (g)  n Z (g) △H > 0,将X和Y以一定比例混合通入密闭容器中进行反应,各物质的浓度随时间的改变如图所示。下列说法不正确的是( )
n Z (g) △H > 0,将X和Y以一定比例混合通入密闭容器中进行反应,各物质的浓度随时间的改变如图所示。下列说法不正确的是( )

A.反应方程式中n = 1
B.10 min时,曲线发生变化的原因是升高温度
C.10 min时,曲线发生变化的原因是增大压强
D.0~5 min内,用X表示的反应速率为v(X) = 0.08 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三月考(10月)化学试卷(解析版) 题型:选择题
(14分)认真观察下列装置,回答下列问题:
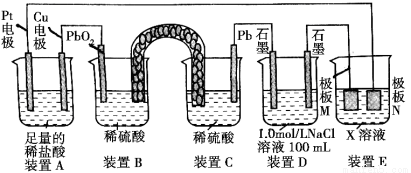
(1)装置B中PbO2上发生的电极反应方程式为________________________________。连接装置B、C的盐桥U形管中通常装填有 。
(2)装置A中总反应的离子方程式为 。装置D中NaCl溶液的pH会 (填“增大”、“不变”或“减小”)。
(3)若装置E的目的是在Cu材料上镀银,则X为__________,极板N的材料为________。若装置E的目的是防止某紫红色金属发生腐蚀,则极板N的材料为 。
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三月考(10月)化学试卷(解析版) 题型:选择题
下列推论正确的是
A.在粗硅的制取中发生反应2C+SiO2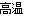 2CO↑+Si,硅被还原,可推知碳的非金属性强于硅的非金属性
2CO↑+Si,硅被还原,可推知碳的非金属性强于硅的非金属性
B.由“HF比HCl稳定性好”,可推知HF比HCl沸点高
C.由“同温度下等浓度的Na2CO3溶液比Na2SO4溶液的pH大”,可推知C比S的非金属性弱
D.由“某过程发生化学键断裂”,可推知该过程发生了化学变化
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三月考(10月)化学试卷(解析版) 题型:选择题
下列有关表述不正确的是
A.—OH与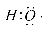 组成元素相同,含有的电子数也相同
组成元素相同,含有的电子数也相同
B.丙烷的分子结构模型示意图: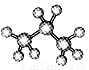
C.次氯酸的电子式为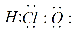
D.熔化时NaHSO4的电离方程式为NaHSO4===Na++HSO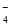
查看答案和解析>>
科目:高中化学 来源:2015届浙江省杭州市高三10月月考化学试卷(解析版) 题型:填空题
(5分)某同学在一只烧杯里装入a g 纯铁粉,加入200 mL 6 mol·L-1硝酸恰好完全溶解铁粉(假设还原产物只有NO)。请完成对产物中铁元素价态的探究:
(1)提出合理假设:
假设1:产物中只有+2价铁;假设2:__________________;假设3:_________________。
(2)设计实验:分别取反应后溶液装入甲、乙两支试管,在甲试管中滴加酸性高锰酸钾溶液;在乙试管中滴加KSCN溶液,观察现象。推测实验现象与结论:
①若现象为:________________________,则假设1正确;
②若现象为:________________________,则假设2正确;
③若现象为:________________________,则假设3正确。
查看答案和解析>>
科目:高中化学 来源:2015届浙江省杭州市高三10月月考化学试卷(解析版) 题型:选择题
有200mL MgCl2和AlCl3的混合溶液,其中c(Mg2+)=0.2 mol/L,c(Cl-)=1.3 mol/L,要使Mg2+全部转化为沉淀分离出来,至少需要4mol/L NaOH 溶液的体积是
A. 40mL B.72 mL C. 80 mL D.128mL
查看答案和解析>>
科目:高中化学 来源:2015届浙江省杭州市高三10月月考化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.强电解质都是离子化合物,因此NaCl是离子化合物
B.醋酸溶液的导电能力可能比稀硫酸强
C.SO3溶于水,其水溶液能导电,SO3是电解质
D.硫磺是单质,不导电,因此硫磺是非电解质
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三上学期第二次质量检测化学试卷(解析版) 题型:选择题
热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池的总反应方程式为:PbSO4+2LiCl+Ca = CaCl2+Li2SO4+Pb。
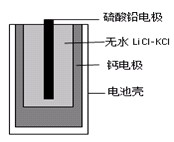
下列有关说法正确的是
A.正极反应式:Ca +2Cl--2e-=CaCl2
B.放电过程中,Li+向负极移动
C.每转移0.1mol电子,理论上生成20.7gPb
D.常温时,在正负极间接上电流表或检流计,指针不偏转
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com