


科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:2011-2012学年山东省日照市高三12月月考化学试卷 题型:填空题
(12分)短周期主族元素A、B、C、D、E、F的原子序数依次增大,它们的原子核外电子层数之和为13。已知B元素形成的化合物种类最多,D元素原子最外层电子数是次外层电子数的3倍,元素E的原子半径在同周期中最大,F元素原子最外层电子数等于其电子层数。
(1)C元素在元素周期表中的位置是_____________________,B的单质与C的最高价氧化物对应水化物的浓溶液发生反应的化学方程式是_________________
__________________________________________________________________________。
(2)由A、B、D、E四种元素形成的化合物中所含的化学键类型是_______________
_________________________________________________________。
(3)写出E2D2与A2D反应的离子方程式
_______________________________________________________________________。
(4)实验室配制100mL0.2mol·L—1由A、D、E形成化合物的溶液,需要用到的玻璃仪器除烧杯、量筒外还有_________________________;如果定容时仰视刻度线,则所配制溶液浓度______________0.2mol·L—1(埴“>”、“<”或“=”)。将F的单质溶于上述配制的溶液中所发生反应的离子方程式是_________________________________________
查看答案和解析>>
科目:高中化学 来源:2010-2011学年陕西省西安市高三第三次质检(理综)化学部分 题型:填空题
A、B、C、D、E、F、G、H八种元素都是前4周期元素,且原子序数依次增大。
已知:元素A的原子中没有成对电子。
元素B、C、D同周期,元素B、G同主族,且B、D、G三原子P轨道上均有2个未成对电子
元素E、F、G在同一周期,且E原子中没有未成对电子。
元素H的基态原子核外有6个未成对电子。
请回答下列问题:
(1)B、C、D三元素的电负性由大到小排列顺序为 (用元素符号表示);E、F、G三元素的原子的第一电离能由大到小排列顺序为 (用元素符号表示)。
(2)元素D与G所形成的晶体和元素D与B所形成的晶体熔沸点由高到低的顺序为 (填化学式),其原因是 。
(3)元素B与C的气态氢化物在A B中溶解性由大到小的顺序为 (填化学式),其原因是
。
B中溶解性由大到小的顺序为 (填化学式),其原因是
。
(4)B、D两元素形成的阴离子BD 中的B的杂化类型为 ,空间结构为
,与BD
中的B的杂化类型为 ,空间结构为
,与BD 互为等电子体且含C、D两元素的微粒的化学式为 。
互为等电子体且含C、D两元素的微粒的化学式为 。
(5)A、B、C三元素各一个原子形成的分子中 键与
键与 键的个数比为 ,该分子的VSERR模型 。
键的个数比为 ,该分子的VSERR模型 。
(6)元素H的基态原子的核外电子排布为 ,在周期表中处于 区。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E、F、G、H八种元素都是前4周期元素,且原子序数依次增大。
已知:元素A的原子中没有成对电子。
元素B、C、D同周期,元素B、G同主族,且B、D、G三原子P轨道上均有2个未成对电子
元素E、F、G在同一周期,且E原子中没有未成对电子。
元素H的基态原子核外有6个未成对电子。
请回答下列问题:
(1)B、C、D三元素的电负性由大到小排列顺序为 (用元素符号表示);E、F、G三元素的原子的第一电离能由大到小排列顺序为 (用元素符号表示)。
(2)元素D与G所形成的晶体和元素D与B所形成的晶体熔沸点由高到低的顺序为 (填化学式),其原因是 。
(3)元素B与C的气态氢化物在A![]() B中溶解性由大到小的顺序为 (填化学式),其原因是 。
B中溶解性由大到小的顺序为 (填化学式),其原因是 。
(4)B、D两元素形成的阴离子BD![]() 中的B的杂化类型为 ,空间结构为 ,与BD
中的B的杂化类型为 ,空间结构为 ,与BD![]() 互为等电子体且含C、D两元素的微粒的化学式为 。
互为等电子体且含C、D两元素的微粒的化学式为 。
(5)A、B、C三元素各一个原子形成的分子中![]() 键与
键与![]() 键的个数比为 ,该分子的VSERR模型 。
键的个数比为 ,该分子的VSERR模型 。
(6)元素H的基态原子的核外电子排布为 ,在周期表中处于 区。
查看答案和解析>>
科目:高中化学 来源:2011届陕西省西安市高三第三次质检(理综)化学部分 题型:填空题
A、B、C、D、E、F、G、H八种元素都是前4周期元素,且原子序数依次增大。
已知:元素A的原子中没有成对电子。
元素B、C、D同周期,元素B、G同主族,且B、D、G三原子P轨道上均有2个未成对电子
元素E、F、G在同一周期,且E原子中没有未成对电子。
元素H的基态原子核外有6个未成对电子。
请回答下列问题:
(1)B、C、D三元素的电负性由大到小排列顺序为 (用元素符号表示);E、F、G三元素的原子的第一电离能由大到小排列顺序为 (用元素符号表示)。
(2)元素D与G所形成的晶体和元素D与B所形成的晶体熔沸点由高到低的顺序为 (填化学式),其原因是 。
(3)元素B与C的气态氢化物在A B中溶解性由大到小的顺序为 (填化学式),其原因是 。
B中溶解性由大到小的顺序为 (填化学式),其原因是 。
(4)B、D两元素形成的阴离子BD 中的B的杂化类型为 ,空间结构为 ,与BD
中的B的杂化类型为 ,空间结构为 ,与BD 互为等电子体且含C、D两元素的微粒的化学式为 。
互为等电子体且含C、D两元素的微粒的化学式为 。
(5)A、B、C三元素各一个原子形成的分子中 键与
键与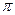 键的个数比为 ,该分子的VSERR模型 。
键的个数比为 ,该分子的VSERR模型 。
(6)元素H的基态原子的核外电子排布为 ,在周期表中处于 区。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com