
【题目】Ⅰ、研究性学习小组进行SO2的制备及性质探究实验,装置如图(a为活塞,加热及固定装置已略去)。
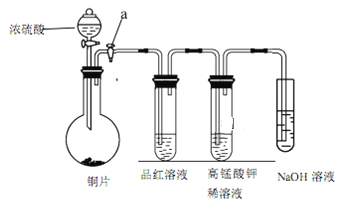
(1)连接仪器、___、加药品后,打开 a,然后滴入浓硫酸,加热;
(2)铜与浓硫酸反应制备 SO2的化学方程式是___;
(3)品红溶液中的实验现象是___;
(4)从高锰酸钾溶液中观察到的现象说明 SO2具有___性。
Ⅱ、上述实验中 NaOH 溶液用于吸收剩余的 SO2 生成 Na2SO3,Na2SO3是抗氧剂。向烧碱和Na2SO3混合溶液中加入少许溴水,振荡后溶液变为无色。
(1)写出在碱性溶液中Br2氧化Na2SO3的离子方程式___
(2)反应后的溶液含有SO32-、SO42-、Br-、OH-等阴离子,请填写鉴定其中SO42-和Br-的实验报告。___
限选试剂:2mol·L-1HCl;1mol·L-1H2SO4;lmol·L-1BaCl2;lmol·L-1Ba(NO3)2;0.1mol·L-1AgNO3;CCl4;新制氯水。
编号 | 实验操作 | 预期现象和结论 |
步骤① | 取少量待测液加入试管中,加入过量的2mol·L-1盐酸,再滴加 | 有 生成,证明待测液中SO42- |
步骤② | 取出步骤①中适量上层清液于试管中,加入适量氯水,再加入 ,振荡,静置。 | 下层液体呈 ,证明待测液中含Br-。 |
【答案】检查装置气密性 Cu +2H2SO4(浓)![]() CuSO4+SO2↑+2H2O 品红溶液红色褪去变为无色 还原性 SO32-+Br2+2OH-=H2O+SO42-+2Br-
CuSO4+SO2↑+2H2O 品红溶液红色褪去变为无色 还原性 SO32-+Br2+2OH-=H2O+SO42-+2Br-
编号 | 实验操作 | 预期现象和结论 |
步骤① | lmol·L-1BaCl2溶液 | 有白色沉沉淀生成 |
步骤② | 四氯化碳 | 橙黄色 |
【解析】
Ⅰ、(1)依据装置制备气体验证气体性质分析步骤;
(2)铜和浓硫酸加热反应生成硫酸铜、二氧化硫和水;
(3)依据二氧化硫的漂白性解释;
(4)二氧化硫通入高锰酸钾溶液中发生氧化还原反应使高锰酸钾溶液褪色;
II、(1) Na2SO3和溴发生氧化还原反应;
(2)检验SO42-,可用硝酸酸化的BaCl2;检验Br2,可用氯水,加入四氯化碳后,根据四氯化碳层的颜色进行判断。
Ⅰ、(1)装置是制备气体的反应,连接好装置需要检验装置的气密性,再加入试剂发生反应;
故答案为检验装置气密性;
(2)铜和浓硫酸加热反应生成硫酸铜、二氧化硫和水,反应的化学方程式:Cu +2H2SO4(浓)![]() CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
故答案为Cu +2H2SO4(浓)![]() CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
(3)二氧化硫具有漂白性,能使品红溶液红色褪去;
故答案为品红溶液红色褪去变为无色;
(4)二氧化硫具有还原性通入高锰酸钾溶液被氧化为硫酸,高锰酸钾溶液紫红色褪去变化为无色;
故答案为还原性;
II、(1)向烧碱和Na2SO3混合溶液中加入少许溴水,振荡后溶液变为无色,说明亚硫酸根离子被溴单质氧化为硫酸跟,依据得失电子守恒和原子守恒配平写出离子方程式为:SO32-+Br2+2OH-=H2O+SO42-+2Br-;
故答案为SO32-+Br2+2OH-=H2O+SO42-+2Br-;
(2)、检验SO42-可取少量待测液加入试管中,加入过量的2 mol/L盐酸,再滴加适量l mol/LBaCl2溶液;检验Br-,可取出步骤①中适量上层清液于试管中,加入适量氯水,再加入四氯化碳,振荡,静置后观察颜色,如若下层液体呈橙红色,证明待测液中含Br-;
故答案为
编号 | 实验操作 | 预期现象和结论 |
步骤① | lmol·L-1BaCl2溶液 | 有白色沉沉淀生成 |
步骤② | 四氯化碳 | 橙黄色 |
。


科目:高中化学 来源: 题型:
【题目】探究无机盐X(仅含三种短周期元素)的组成和性质,设计并完成如下实验:
请回答:
(1)X的化学式是____。
(2)白色粉末溶于氢氧化钠溶液的离子方程式是____。
(3)高温条件下白色粉末与焦炭发生置换反应,写出该反应的化学方程式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列溶液均为![]() ,有关叙述正确的是( )
,有关叙述正确的是( )
A.碳酸氢钠溶液中![]()
B.碳酸钠溶液比碳酸氢钠溶液的pH小
C.碳酸钠溶液中![]()
D.碳酸钠溶液中滴加盐酸至pH=7,所得溶液的溶质只有NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于 H2O 和 H2S 的说法正确的是
A.H2O 比 H2S 稳定,是因为 H2O 分子间有氢键,而 H2S 分子间只有范德华力
B.二者中心原子杂化方式均为 sp2 杂化
C.H2S 的水溶液呈酸性,而 H2O 成中性,说明 O 元素的非金属性强于 S 元素
D.键角 H2O 大于 H2S,是因为氧的电负性大于硫,两个 O-H 键之间的排斥力大于两个 S-H 键的排斥力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1934年,居里夫妇![]() 粒子(4He)轰击27Al得到一种自然界中不存在的磷元素的一种核素(
粒子(4He)轰击27Al得到一种自然界中不存在的磷元素的一种核素(![]() ):
):![]() +
+![]()
![]()
![]() +
+![]() ,开创了人造核素的先河。
,开创了人造核素的先河。
(1)下列有关说法正确的有______(填序号)。
A. ![]() 的质子数是27 B.
的质子数是27 B. ![]() 是一种电中性粒子
是一种电中性粒子
C. ![]() 和
和![]() 互为同位素 D. P元素的相对原子质量为30
互为同位素 D. P元素的相对原子质量为30
(2)元素的化学性质主要取决于______(填序号)。
A. 原子最外层电子数 B. 原子核内中子数
C. 原子核内质子数 D. 原子质量数
(3)不同种元素的本质区别是______(填序号)。
A. 原子的质子数不同 B. 原子的中子教不同
C. 原子的最外层电子数不同 D. 原子的质量数不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是
A.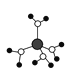 水合铜离子的模型如图所示,1个水合铜离子中有4个配位键
水合铜离子的模型如图所示,1个水合铜离子中有4个配位键
B.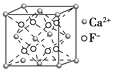 CaF2晶体的晶胞如图所示,与每个Ca2+距离最近的F-为4个
CaF2晶体的晶胞如图所示,与每个Ca2+距离最近的F-为4个
C. H原子的电子云图如图所示为球形
H原子的电子云图如图所示为球形
D. 金属Cu的原子堆积模型如图所示,为最密堆积,每个Cu原子的配位数均为12
金属Cu的原子堆积模型如图所示,为最密堆积,每个Cu原子的配位数均为12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚铁氰化钾(K4[Fe(CN)6])双称黄血盐,是一种重要的化工原料。检验三价铁发生的反应为:K4[Fe(CN)6]+FeCl3=KFe[Fe(CN)6]↓(滕氏蓝)+3KCl,回答问题:
(1)写出基态Fe3+的核外电子排布式___。
(2)K4[Fe(CN)6]中的作用力除共价键外,还有___和___。
(3)黄血盐中N原子的杂化方式为____;C、N、O的第一电离能由大到小的排序为___,电负性由大到小的排序为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.将过量NaOH溶液滴入Ca(HCO3)2溶液中:Ca2++HCO3-+OH-=CaCO3↓+H2O
B.Fe(OH)3溶于氢碘酸: Fe(OH)3 + 3H+ =Fe3+ + 3H2O
C.泡沫灭火器灭火原理:2A13++3CO32-+3H2O=2Al(OH)3↓+3CO2↑
D.向NH4HCO3溶液中加入过量的Ba(OH)2溶液并加热:Ba2++ 2OH-+NH4++ HCO3-![]() NH3↑+2H2O+BaCO3↓
NH3↑+2H2O+BaCO3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一些净水器推销商在推销其产品时,进行所谓的“电解水法”实验,将纯净水与自来水进行对比。当电解装置插入纯净水和自来水中通电数分钟后,纯净水颜色无变化或略显黄色,而自来水却冒出气泡并生成灰绿色或红棕色的沉淀。根据上述现象,下列选项说法正确的是( )
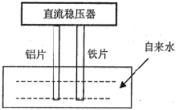
A.通电时,铝片做阳极,铁片做阴极
B.生成的气泡、红棕色或灰绿色的沉淀都是电解的直接或间接产物
C.通过对比,确实能说明自来水中含有大量对人体有毒有害的物质
D.铁片的电极反应:O2+2H2O+4e-=4OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com