
分析 A在常温下是一种气体单质,且是最轻的气体,则A是氢气,B在常温下是黄绿色气体,则B为Cl2,C是一种可以被磁铁吸引的常见金属铁,由此分析解答.
解答 解:A在常温下是一种气体单质,且是最轻的气体,则A是氢气,B在常温下是黄绿色气体,则B为Cl2,C是一种可以被磁铁吸引的常见金属铁,
(1)A是氢气、B是氯气,故答案为:氢气;氯气;
(2)C是铁,其元素符号是Fe,故答案为:Fe;
(3)氢气与氯气在点燃条件下反应的化学方程式是:H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl;故答案为:H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl.
点评 本题考查了氯气与氢气的反应,熟悉氯气的性质及氯化氢的性质是解题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | F | H | |||||
| 3 | B | C | E | G |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “歼-2-“飞机上使用的碳纤维是一种新型的有机高分子材料 | |
| B. | ”辽宁舰”上用于舰载机肇落拦阻索的特种钢缆,属于新型无机非金属材料 | |
| C. | 军舰船底镶嵌锌块,可防船体被腐蚀是应用了牺牲阳极的阴极保护法 | |
| D. | 工业上可用氢氟骏与二氧化硅反应进行玻璃雕花,而盐酸不与二氧化硅反立,说明氢氟酸的酸性比盐酸的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
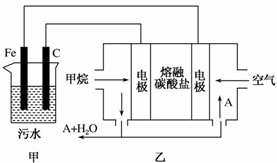 工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3.Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用.某科研小组用该原理处理污水,设计的装置如图所示.下列说法正确的是( )
工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3.Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用.某科研小组用该原理处理污水,设计的装置如图所示.下列说法正确的是( )| A. | 为了增加污水的导电能力,应向污水中加入适量的H2SO4溶液 | |
| B. | 甲装置中Fe电极的反应为Fe-3e-═Fe3+ | |
| C. | 为了使燃料电池乙长时间稳定运行,电池的电解质组成应保持稳定,电池工作时,循环的物质A为CO2 | |
| D. | 当乙装置中有1.6 gCH4参加反应时,C电极理论上生成气体的体积在标况下为4.48 L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 必为第1层 | B. | 只能是第2层 | C. | 只能是第3层 | D. | 可以是任意层 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com