
| A. | ①③⑤ | B. | ②④⑦ | C. | ①②⑥ | D. | ②③⑥ |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LH2O含有的分子数为1 NA | |
| B. | 常温常压下,16g O2含有的原子数为1 NA | |
| C. | 通常状况下,1 NA 个SO2分子占有的体积为22.4L | |
| D. | 物质的量浓度为0.5mol/L的K2CO3溶液中,含有CO32-个数为0.5 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与空气 | B. | 铝盐与氢氧化钠溶液 | ||
| C. | CO2通入石灰水 | D. | 过氧化钠与水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
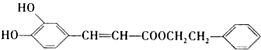 是一种天然抗癌药物,在一定条件下能发生如下转化:
是一种天然抗癌药物,在一定条件下能发生如下转化: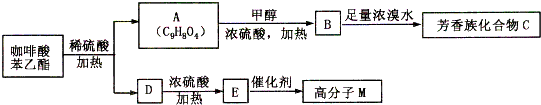
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. | 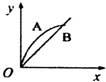 | C. | 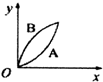 | D. | 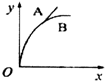 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
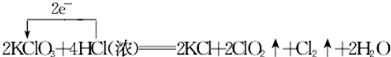 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
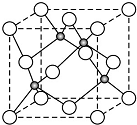 原子序数小于36的X、Y、Z、W四种元素,其中X是半径最小的元素,Y原子基态时成对电子数是其未成对电子总数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W原子4s原子轨道上有1个电子,M能层为全充满的饱和结构.回答下列问题:
原子序数小于36的X、Y、Z、W四种元素,其中X是半径最小的元素,Y原子基态时成对电子数是其未成对电子总数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W原子4s原子轨道上有1个电子,M能层为全充满的饱和结构.回答下列问题: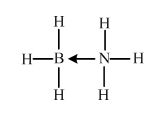 (必须标明配位键)
(必须标明配位键)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com