
下列实验方案设计中,不能达到实验目的的是
| 选项 | 实验目的 | 实验方案 |
| A | 验证乙烯与溴发生加成反应 | 乙烯通入溴水中,测定反应前后溶液pH |
| B | 检验氯化铁溶液中是否含FeCl2 | 向氯化铁溶液中滴加铁氰化钾溶液 |
| C | 检验乙酸中是否混有乙醇 | 取样液于试管,加入一绿豆颗粒大的钠粒 |
| D | 验证Ksp(AgI)<Ksp(AgCl) | 向含等物质的量NaCl、KI的混合液中滴加AgNO3溶液 |
科目:高中化学 来源: 题型:
卤代烃在工农业生产及人们的生活中具有广泛的用途。如四氯化碳可用作灭火剂、氟利昂曾用作冷冻剂、氯仿曾用作麻醉剂,卤代烃还是合成高分子化合物的原料。
已知下面三个反应(其中A为氯代烃,B为烯烃)
反应①:A B
B
反应②:B CH3COOH+CO2↑+H2O
CH3COOH+CO2↑+H2O
反应③:CH3CH2CH===CH2+HBr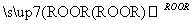 CH3CH2CH2CH2Br
CH3CH2CH2CH2Br
请回答下列问题:
(1)化合物B的分子式为________,1 mol化合物B完全燃烧需要消耗标准状况下________L的氧气。
(2)由丙醇可以制备B,该反应的反应条件为________,反应类型为__________________。
(3)假设A在核磁共振氢谱中有两组峰,且峰面积之比为6∶1,那么A在氢氧化钾水溶液中加热反应生成的有机化合物的结构简式为。
(4)写出B在有机过氧化物(R—O—O—R)中与HBr反应的化学方程式:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,在2L的密闭容器中,加入1molX(g)和2molY(g)发生反应:X(g)+m Y(g)
 3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
A、 m=2
B、 两次平衡的平衡常数相同
C、 X与Y的平衡转化率之比为1:1
D、 第二次平衡时,Z的浓度为0.4 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
[化学---有机化学基础]
菠萝酯F是一种具有菠萝香味的赋香剂,其合成路线如下:
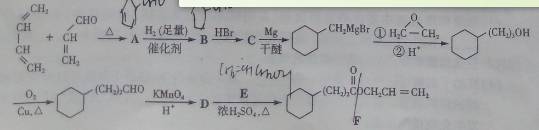
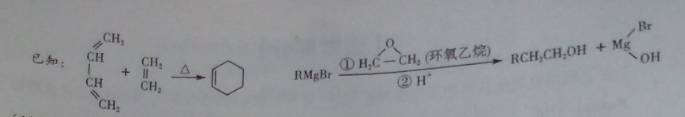
(1)A的结构简式为_________________,A中所含官能团的名称是_________。
(2)由A生成B的反应类型是______________,E的某同分异构体只有一种相同化学环境的氢,该同分异构体的结构简式为_________________。
(3)写出D和E反应生成F的化学方程式________________________。
(4)结合题给信息,以溴乙烷和环氧乙烷为原料制备1-丁醇,设计合成路线(其他试剂任选)。

查看答案和解析>>
科目:高中化学 来源: 题型:
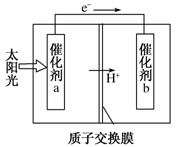
人工光合作用能够借助太阳能,用CO2和H2O制备化学原料。如图是通过人工光合作用制备HCOOH的原理示意图,下列说法不正确的是( )
A.该过程是将太阳能转化为化学能的过程
B.催化剂a表面发生氧化反应,有O2产生
C.催化剂a附近酸性减弱,催化剂b附近酸性增强
D.催化剂b表面的反应是CO+2H++2e-===HCOOH
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏伽德罗常数的值。下列说法正确的是
A.0.2molAl与足量NaOH溶液反应,生成的H2分子数为0.3NA
B.常温下,1LpH=1的盐酸溶液,由水电离的H+离子数目为0.1NA
C.铅蓄电池中,当正极增加9.6g时,电路中通过的电子数目为0.2NA
D.11P4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4 反应中,6 mol CuSO4能氧化白磷的分子数为1.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
现有物质的量浓度均为0.1 mol·L-1的四种溶液各25mL:①氨水 ②NH4Cl溶液 ③Na2CO3溶液 ④NaHCO3溶液,下列说法正确的是
A.4种溶液pH的大小顺序:①>④>③>②
B.①、②混合后pH>7,则混合溶液中c(NH4+)<c(NH3·H2O)
C.①、②中分别加入25 mL 0.1 mol·L-1盐酸后,溶液中c(NH4+):①>②
D.③、④中分别加入12.5 mL 0.1mol·L-1 NaOH溶液后,两溶液中离子种类相同
查看答案和解析>>
科目:高中化学 来源: 题型:
CuCl2、CuCl是重要的化工原料,广泛地用作有机合成催化剂。实验室中以粗铜(含杂质Fe)为原料,一种制备铜的氯化物的流程如下:
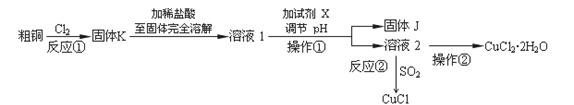
请回答下列问题:
(1)如图装置进行反应①,导管a通入氯气
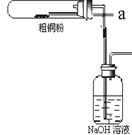 (夹持仪器和加热装置省略)。观察到的现象是 ,
(夹持仪器和加热装置省略)。观察到的现象是 ,
写出铜与氯气反应的化学方程式 。
(2)上述流程中固体K溶于稀盐酸的目的是 。
试剂X、固体J的物质分别为 。
a.NaOH Fe(OH)3 b.NH3·H2O Fe(OH)2
c.CuO Fe(OH)3 d.CuSO4 Cu(OH)2
(3)反应②是向溶液2中通入一定量的SO2,加热一段时间
后生成CuCl白色沉淀。写出制备CuCl的离子方程式 。
(4)反应后,如图盛有NaOH溶液的广口瓶中溶液具有漂白、消毒作用,若用钢铁(含Fe、C)制品盛装该溶液会发生电化学腐蚀,钢铁制品表面生成红褐色沉淀,溶液会失去漂白、杀菌消毒功效。该红褐色沉淀的主要化学式是 。该腐蚀过程的正极反应式为 。
(5)以石墨为电极,电解CuCl2溶液时发现阴极上也会有部分CuCl析出,写出此过程中阴极上的电极反应式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某溶液中只存在OH-、H+、NH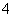 、Cl-四种离子,某同学推测其离子浓度大小顺序可能有如下四种关系:
、Cl-四种离子,某同学推测其离子浓度大小顺序可能有如下四种关系:
①c(Cl-)>c(NH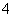 )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
②c(NH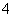 )>c(OH-)>c(Cl-)>c(H+)
)>c(OH-)>c(Cl-)>c(H+)
③c(NH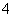 )>c(Cl-)>c(OH-)>c(H+)
)>c(Cl-)>c(OH-)>c(H+)
④c(Cl-)>c(H+)>c(NH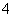 )>c(OH-)
)>c(OH-)
填写下列空白:
(1)若溶液中只溶有一种溶质,则该溶质是________,上述四种离子浓度的大小顺序为________(填序号)。
(2)若四种离子的关系符合③,则溶质为________;若四种离子的关系符合④,则溶质为________。
(3)将pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数,则下面图像正确的是________(填图像符号)。

(4)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)________c(NH3·H2O)(填“大于”、“小于”或“等于”,下同);混合前酸中c(H+)和碱中c(OH-)的关系为c(H+)________c(OH-)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com