
| A. | 标准状况下,11.2LCCl4中含有的分子数为0.5NA | |
| B. | 在Na2O2与水的反应中,每生成1molO2,转移电子数目为2NA | |
| C. | 常温常压下,等物质的量浓度的Na2CO3与Na2S溶液Na+数目相等 | |
| D. | 常温常压下,4.6g乙醇中含有极性共价键的数目为0.8NA |
分析 A.标准状况下,CCl4不是气体,不能使用标况下的气体摩尔体积计算CCl4的物质的量;
B.Na2O2与H2O的反应2Na2O2+2H2O=4NaOH+O2↑,此反应转移2mol电子,生成1molO2;
C.计算溶液中离子数目需要离子浓度和溶液体积;
D.求出乙醇的物质的量,然后根据乙醇中含8条共价键来分析.
解答 解:A.标况下,CCl4不是气体,不能使用标况下的气体摩尔体积计算11.2LCCl4的物质的量,故A错误;
B.Na2O2与H2O的反应2Na2O2+2H2O=4NaOH+O2↑,此反应转移2mol电子,生成1molO2,故生成1molO2,转移电子数目为2NA,故B正确;
C.计算溶液中离子数目需要离子浓度和溶液体积,等物质的量浓度的Na2CO3与Na2S溶液无溶液体积,故不能得到Na+数目相等,故C错误;
D.4.6g乙醇的物质的量为n=$\frac{4.6g}{46g/mol}$=0.1mol,而乙醇中含8条共价键,故0.1mol乙醇中含0.8mol共价键即0.8NA个,故D错误;
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,注意气体摩尔体积使用条件和对象,题目难度中等.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | 可燃冰可能在未来汽车“燃油”替变为“燃冰” | |
| B. | 可燃冰即使开采不当也不会造成“温室效应” | |
| C. | 可燃冰中有一种甲烷气体,甲烷属无机物 | |
| D. | 可燃冰中的乙醚与乙醇互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化氯具有强氧化性,可用来漂白织物 | |
| B. | 氯化铝是强电解质,可电解其水溶液获得金属铝 | |
| C. | 石英坩埚耐高温,可用来加热熔化烧碱、纯碱等固体 | |
| D. | 铜的金属活动性比铝弱,可用铜罐代替铝罐贮运浓硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 提出了元素周期律 | B. | 提出了杂化轨道理论 | ||
| C. | 发现了电子 | D. | 发现了能量最低原理 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业生产玻璃、水泥、漂白粉,均需要用石灰石为原料 | |
| B. | 某雨水样品放置一段时间后,pH由4.68变为4.00,是因为水中溶解的CO2增多 | |
| C. | 药皂中含有的苯酚具有强氧化性,能杀菌消毒 | |
| D. | 胶体具有介稳性的主要原因是因胶体粒子所作的布朗运动使它们不容易聚集成质量较大的颗粒而沉降下来 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

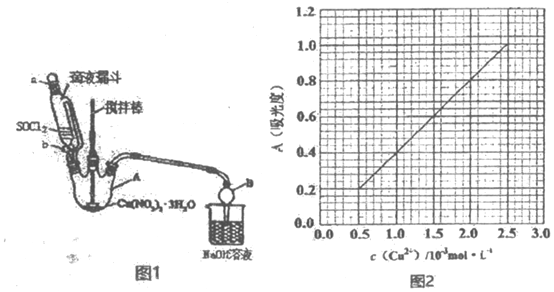
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
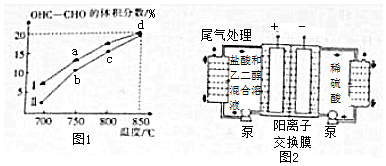
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
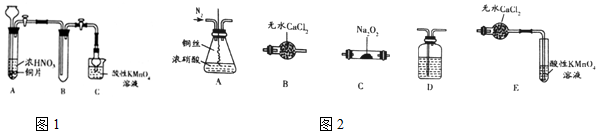
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| 选项 | 实验目的 | 解释 | |
| A | 图1 | 检验产物 | 错误,乙醇也能使高锰酸钾褪色 |
| B | 图2 | 配制银氨溶液 | 错误,只能制得沉淀 |
| C | 图3 | 比较醋酸、碳酸、苯酚酸性强弱 | 正确,可以发生预期现象 |
| D | 图4 | 制取乙酸乙酯并分离 | 正确,用氢氧化钠可以除去乙酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com