
 ����ͭ�����ճ������г����Ľ��������Ź㷺����;����ش��������⣺
����ͭ�����ճ������г����Ľ��������Ź㷺����;����ش��������⣺���� ��1��Feԭ�Ӻ��������Ϊ26�������������ԭ����д��������Ų�ʽ��
��2�����Ӿ�����۷е�ϵͣ������Fe��CO��x������ԭ������ԭ�ӣ���۵�������8��ÿ�������ṩ�ĵ�������2���ݴ��ж�xֵ�������������ж��γɵĻ�ѧ����
��3��K3[Fe��CN��6]��Fe2+�������������ɫ�����������ڼ���Fe2+������Cԭ�Ӽ۲���ӶԸ���ȷ���ӻ���ʽ��һ����˵�ǽ�����Խǿ����һ������Խ������Ϊp����������ϵ���к�ǿ���ȶ��ԣ�������������N��p����������ǰ�����ģ�O��p���ʧȥһ�����Ӳ��ǰ�����ģ�����O��N����ʧȥ���ӣ�
��4����ͭΪ29��Ԫ�أ�λ�����ڱ��е������ڵڢ�B�壻
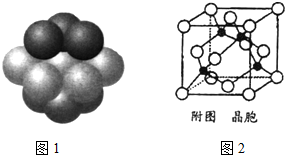
�ڸ��ݾ����ṹͼ��֪��ͭΪ���������ѻ����ݴ��ж�ÿ��ͭԭ����Χ���������ͭԭ����Ŀ��
��5�����ݼ۵����Ų�ʽ�жϳ�Xԭ��ΪClԭ�ӣ�
�����þ�̯������ó���
�ڸ��ݵ縺�Բ�ֵ�жϻ��������ͣ�
�ۼ����һ�����������������û������Ħ���������ܶȼ���������߳������ݾ����Ľṹ��֪��ͭԭ�Ӻ�Mԭ��֮�����̾���Ϊ��������Խ��ߵ�$\frac{1}{4}$��
��� �⣺��1��Feԭ�Ӻ��������Ϊ26�������������ԭ������������Ų�ʽΪ��1s22s22p63s23p63d64s2��
�ʴ�Ϊ��1s22s22p63s23p63d64s2��
��2�����Ӿ�����۷е�ϵͣ����������Ϣ֪�������ʵ��۷е�ϵͣ�����Ϊ���Ӿ��壬�����Fe��CO��x������ԭ������ԭ�ӣ���۵�������8��ÿ�������ṩ�ĵ�������2��8+2x=18��x=5��Fe��CO��5��һ�������·����ֽⷴӦ��Fe��CO��5=Fe��s��+5CO����Ӧ����Fe�������γɵĻ�ѧ��Ϊ��������һ����̼�к��й��ۼ��������������к��н����������ۼ���
�ʴ�Ϊ�����Ӿ��壻5�������������ۼ���
��3��K3[Fe��CN��6]��Fe2+�������������ɫ�����������ڼ���Fe2+��CN-��Cԭ�Ӽ۲���ӶԸ���=1+$\frac{1}{2}$��4+1-1��3��=2�����Բ�ȡsp�ӻ���һ����˵�ǽ�����Խǿ����һ�����ܴ�����Ϊp����������ϵ���к�ǿ���ȶ��ԣ�N��p����������ǰ�����ģ�O��p���ʧȥһ�����Ӳ��ǰ�����ģ�����C��N��O��Ԫ�صĵ�һ�������ɴ�С��˳��ΪN��O��C��
�ʴ�Ϊ��Fe2+��sp�ӻ���N��O��C��
��4����ͭΪ29��Ԫ�أ�λ�����ڱ��е������ڵڢ�B�壬
�ʴ�Ϊ���������ڵڢ�B�壻
�ڸ��ݾ����ṹͼ��֪��ͭΪ���������ѻ�������ÿ��ͭԭ����Χ���������ͭԭ��λ�ھ�����ԭ�ӵ����������������ϣ�����12����
�ʴ�Ϊ��12��
��5�����ݼ۵����Ų�ʽ�жϳ�Xԭ��ΪClԭ�ӣ�
���ɾ����ṹ��֪��Cuԭ�Ӵ��ھ����ڲ��������к���4��Cuԭ�ӣ�Clԭ�����ڶ����������ϣ������к���Clԭ����ĿΪ8��$\frac{1}{8}$+6��$\frac{1}{2}$=4���ʻ�ѧʽΪCuCl��
�ʴ�Ϊ��CuCl��
�ڵ縺�Բ�ֵ����1.7ԭ�Ӽ����γ����Ӽ���С��1.7ԭ�Ӽ��γɹ��ۼ���ͭ��X�ĵ縺�Էֱ�Ϊ1.9��3.0����ֵΪ1.1С��1.7���γɹ��ۼ���
�ʴ�Ϊ�����ۣ�
��һ��������Ħ������Ϊ4��99.5g/mol������Ħ�����Ϊ $\frac{4��99.5}{��{N}_{A}}$cm3�������ı߳�Ϊ$\root{3}{\frac{4��99.5}{��{N}_{A}}}$ cm�����ݾ����Ľṹ��֪��ͭԭ�Ӻ�Mԭ��֮�����̾���Ϊ��������Խ��ߵ�$\frac{1}{4}$������Խ���Ϊ�����߳���$\sqrt{3}$ ��������ͭԭ�Ӻ�Mԭ��֮�����̾���Ϊ $\frac{\sqrt{3}}{4}$��$\root{3}{\frac{4��99.5}{��{N}_{A}}}$cm=$\frac{\sqrt{3}}{4}$$\root{3}{\frac{4��99.5}{��{N}_{A}}}$��1010 pm��
�ʴ�Ϊ��$\frac{\sqrt{3}}{4}$$\root{3}{\frac{4��99.5}{��{N}_{A}}}$��1010 ��
���� ���⿼���Ϊȫ�棬�漰�������Ų�ʽ����һ�����ܡ��ӻ����͵��жϡ�������Լ��йؾ���ļ��㣬��������н�ǿ�ķ����Ժ����ԣ�ѧϰ��ע���ܽ������д�����Ų�ʽ������жϷ��ӿռ乹���Լ��йؾ������ȷ�����


 ѧ�ڸ�ϰһ��ͨѧϰ�ܶ�Ա��ĩ������ӱ����������ϵ�д�
ѧ�ڸ�ϰһ��ͨѧϰ�ܶ�Ա��ĩ������ӱ����������ϵ�д� â���̸����������������ϵ�д�
â���̸����������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
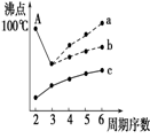 ��ͼ���о�����Ԫ���⻯��ķе�仯���ɵ�ͼ������c���Ա�����ڢ�A��Ԫ���⻯��ķе�仯���ɣ���λͬѧ��ij����Ԫ���⻯��ķе�ı仯���ƻ�������������--����a������b������Ϊ��ȷ����b���a����b������������A����ʾ���⻯����ˮ����е��������ˮ���Ӽ�����������������Ԫ���������⻯��ķе㲻�����ˮ��
��ͼ���о�����Ԫ���⻯��ķе�仯���ɵ�ͼ������c���Ա�����ڢ�A��Ԫ���⻯��ķе�仯���ɣ���λͬѧ��ij����Ԫ���⻯��ķе�ı仯���ƻ�������������--����a������b������Ϊ��ȷ����b���a����b������������A����ʾ���⻯����ˮ����е��������ˮ���Ӽ�����������������Ԫ���������⻯��ķе㲻�����ˮ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Mg2+�Ľṹʾ��ͼ�� | |
| B�� | ����Ļ�ѧʽ��CH3CH2OH | |
| C�� | ����صĵ��뷽��ʽ��K2SO4�T${K}_{2}^{+}$+${SO}_{4}^{2-}$ | |
| D�� | N2�Ľṹʽ��N��N |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| Ԫ�ر�� | Ԫ�����ʻ�ԭ�ӽṹ |
| A | ���������Ӳ㣬K��M�������֮�͵���L������� |
| B | �������н�������ǿ |
| C | �����µ���Ϊ˫ԭ�ӷ��ӣ��⻯���ˮ��Һ�ʼ��� |
| D | Ԫ�����������+7�� |
 ��
��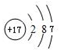 ���ܵ���ʽ��ʾA��BԪ����ɵĻ�������γɹ��̣�
���ܵ���ʽ��ʾA��BԪ����ɵĻ�������γɹ��̣� ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Cu˿ | B�� | ���ڵ�MgCl2 | C�� | �ƾ� | D�� | ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���淴Ӧ | B�� | �κη�Ӧ | C�� | ��Һ�䷴Ӧ | D�� | ����䷴Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ʵ��ٺ͢ھ���֤��K2Cr2O7��Һ�д�������ƽ�� | |
| B�� | ʵ�����˵�������ԣ�Cr2O7 2-��Fe3+ | |
| C�� | CrO42- ��Fe2+��������Һ�п��Դ������� | |
| D�� | ϡ��K2Cr2O7��Һʱ����Һ�и�����Ũ�Ⱦ���С |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

| A�� | ��֪S��l��+O2��g���TSO2��g����H=-293.23kJ•mol-1����S��s��+O2��g���TSO2��g����Ӧ�ų�������С��293.23 kJ/mol | |
| B�� | ��1 mol H2SO4��Ũ��Һ������NaOH��Ӧ���ų���������Ϊ�к��� | |
| C�� | ;������SO2��SO3���������������� | |
| D�� | ����H1����H2+��H3����2H2O2��aq���T2H2O��l��+O2��g��Ϊ���ȷ�Ӧ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com