
 有关氢氧化物开始沉淀和沉淀完全的pH如下表:
有关氢氧化物开始沉淀和沉淀完全的pH如下表:| 氢氧化物 | Al(OH)2 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Pb(OH)2 | Mn(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 | 8.0 | 8.3 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 | 8.8 | 9.8 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 实验 | 除杂试剂 | 实验目的 |
| ① | 电石与水反应 | CuSO4溶液 | 用KMnO4酸性溶液检验乙炔的还原性 |
| ② | CH3CH2Br与NaOH溶液共热 | HNO3溶液 | 用AgNO3溶液检验CH3CH2Br中的Br |
| ③ | 淀粉与稀H2SO4水浴共热 | NaOH溶液 | 用银氨溶液检验水解产物的还原性 |
| ④ | C2H5OH与浓H2SO4加热至170 ℃ | NaOH溶液 | 用Br2的CCl4溶液证明该反应为消去反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 操作 | 现象 | 结论 |
| A | 滴加BaCl2溶液 | 生成白色沉淀 | 原溶液中有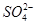 |
| B | 滴加氯水和CCl4,振荡、静置 | 下层溶液显紫色 | 原溶液中有I- |
| C | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+、无K+ |
| D | 滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无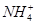 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
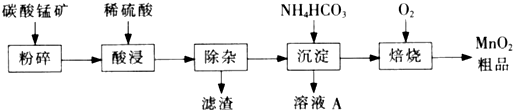
 )如下:
)如下: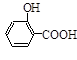 (水杨酸)+SOCl2→
(水杨酸)+SOCl2→ (水杨酰氯)+HCl↑+SO2↑
(水杨酰氯)+HCl↑+SO2↑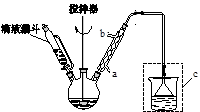
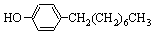 ),温度控制在100℃左右,不断搅拌。
),温度控制在100℃左右,不断搅拌。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

| 金属 离子 | 开始沉淀 的pH | 沉淀完全 的pH |
| Fe3+ | 1. 1 | 3. 2 |
| Al3+ | 3. 0 | 5. 0 |
| Fe2+ | 5. 8 | 8. 8 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
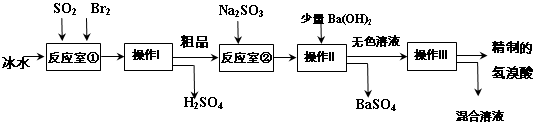
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 物质 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀时 | 1.5 | 3.4 | 6.3 |
| 完全沉淀时 | 2.8 | 4.7 | 8.3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.向某溶液中加稀盐酸,将产生的无色气体通入澄清石灰水中,石灰水变浑浊,则原溶液中一定有CO32-或HCO3- |
| B.向某溶液中加入硝酸钡溶液有白色沉淀产生,再加稀盐酸,沉淀不消失,则原溶液中一定有SO42- |
| C.向某溶液中加入浓氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,则原溶液中存在NH4+ |
| D.向某溶液中加入硝酸银溶液产生白色沉淀,再加稀盐酸,沉淀不消失,则原溶液中一定有Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com