
分析 除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,盐酸要放在最后,用于除去过量的氢氧化钠和碳酸钠,要先加过量的氯化钡除去硫酸根离子,然后用碳酸钠去除过量的钡离子,即必须满足碳酸钠溶液应该在加入氯化钡溶液之后,盐酸必须在过滤之后加入,以此解答该题.
解答 解:要先除硫酸根离子,然后再除钙离子,碳酸钠可以除去过量的钡离子,如果加反了,过量的钡离子就没法除去,至于加氢氧化钠除去镁离子顺序不受限制,因为过量的氢氧化钠加盐酸就可以调节了,注意将三种离子除完,再进行过滤,最后加盐酸除去过量的氢氧根离子和碳酸根离子,顺序为⑤②④①③;
加入碳酸钠,发生Na2CO3+BaCl2=BaCO3↓+2NaCl,Na2CO3+CaCl2=CaCO3↓+2NaCl;
BaCl2已过量,则再加氯化钡不会生成沉淀,则实验方法为用试管取少量第②步操作后的上层清液,再滴入几滴BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量,
故答案为:⑤②④①③;Na2CO3+BaCl2=BaCO3↓+2NaCl,Na2CO3+CaCl2=CaCO3↓+2NaCl;用试管取少量第②步操作后的上层清液,再滴入几滴BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量.
点评 本题考查混合物分离提纯,为高频考点,把握除杂试剂的先后顺序为解答的关键,侧重分析与应用能力的考查,注重元素化合物知识的综合应用,题目难度不大.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 金属钠着火,可用泡沫灭火器扑灭 | |
| B. | 用10 mL量筒准确量取7.50 mL稀硫酸 | |
| C. | 用四氯化碳萃取溴水中的溴时,将溴的四氯化碳溶液从分液漏斗下口放出 | |
| D. | 在氢气还原氧化铜实验中,先加热氧化铜,后通入氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
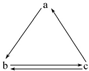 下列所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
下列所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )| 选项 | a | b | c |
| A | S | SO2 | SO3 |
| B | HNO3 | NO | NO2 |
| C | Si | SiO2 | H2SiO3 |
| D | NH3 | NO2 | NO |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 锰及其化合物有广泛应用.
锰及其化合物有广泛应用.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com