
【题目】在密闭容器中的一定量混合气体发生反应,xA(g)+yB(g)![]() zC(g),平衡时测得A的浓度为0.40 mol·L-1,保持温度不变,将容器的容积缩小为原来的一半,再达平衡时,测得A的浓度升高为0.70 mol·L-1。下列有关判断正确的是( )
zC(g),平衡时测得A的浓度为0.40 mol·L-1,保持温度不变,将容器的容积缩小为原来的一半,再达平衡时,测得A的浓度升高为0.70 mol·L-1。下列有关判断正确的是( )
A. x+y>z B. 平衡向逆反应方向移动
C. B的转化率减小 D. C的体积分数减小
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】结合下表回答下列问题(均为常温下的数据):
酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) |
CH3COOH | 1.8×10-5 | H2CO3 | K1=4.4×10-7 K2=4.7×10-11 | H2C2O 4 | K1=5.4×10-2 K2=5.4×10-5 | H2S | K1=1.3×10-7 K2=7.1×10-15 |
HClO | 3×10-8 |
请回答下列问题:
(1)同浓度的CH3COO-、HCO3-、CO32-、HC2O4-、ClO-、S2-中结合H+的能力最弱的是__________。
(2)常温下0.1 molL-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是_______(填序号)。
A.c(H+) B. c(H+)/c(CH3COOH) C. c(H+)/c(OH-) D. c(OH-)
(3)0.1 molL-1的H2C2O4溶液与0.1 molL-1的KOH的溶液等体积混合后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为______________。
(4)pH相同的NaClO和CH3COOK溶液,其溶液的物质的最浓度的大小关系是:CH3COONa______NaClO,两溶液中:[c(Na+)-c(ClO-)]______[c(K+)-c(CH3COO-)](填“>”“<”或“=”)。
(5)向0.1 molL-1CH3COOH 溶液中滴加 NaOH 溶液至 c(CH3COOH): c(CH3COO-)=5 : 9,此时溶液pH=_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列烷烃的沸点是甲烷:-164℃,乙烷-89℃,丙烷:-42℃,戊烷:36℃。由此,推断丁烷的沸点可能:
A.低于-170℃B.约为-1℃C.高于36℃D.-100℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化铝锂(IiAlH4)是有机合成中的重要还原剂。某课题组设计实验制备氢化铝锂并测定其纯度。已知: 氢化铝锂、氢化锂遇水都剧烈反应,并产生同一种气体。
回答下列问题:
I.制备氢化锂(IiH)
选择图1中的装置制备氢化锂(必要时可重复使用):
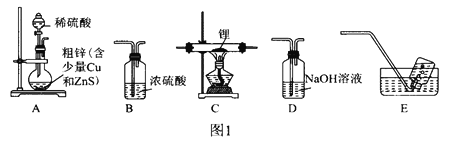
(1)装置D中NaOH溶液的作用是________________________________________。
(2)装置的连接顺序(从左至石)为A→__________________________________。
(3)检验好装置的气密性,点燃酒精灯前需进行的实验操作是____________________________________。
II.制备氢化铝理
1947 年,Schlesinger、Bond 和Finholt首次制得氢化铝理,其方法是使氢化锂与无水三氯化铝按定比例在乙醚中混合,搅拌,充分反应后,经一系列操作得到LiAlH4晶体。
(4)将乙醚换为去离子水是否可行,请简述理出:____________________________________。
(5)氢化锂与无水三氯化铝反应的化学方程式为___________________________________。
III.测定氢化铝锂产品(不含氢化锂)的纯度。
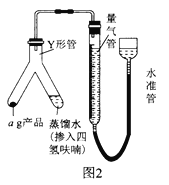
(6)按图2装配仪器、检查装置气密性并装好约品(Y形管中的蒸馏水足量,为了避免氢化铝锂遇水发生爆炸,蒸馏水中需掺入四氢呋喃作稀释剂),启动反应的操作是_________________。读数之前,上下移功量气管在右侧的容器,使量气管左、右两侧的液面在同一水平而上,其目的是___________________________。
(7)标准状况下,反应前量气管读数为V1mL,反应完毕并冷却之后,量气管读数为V2mL。该样品的纯度为_____________________(用含a、V1、V2的代数式表示)。若起始读数时俯视刻度线,测得的结果将___________(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是资源的宝库,海水淡化可获得淡水和浓海水。浓海水中主要含有的离子有Na+、 Mg2+ 、Cl﹣、SO42﹣。从浓海水中提取金属镁的一段工艺流程如图所示:
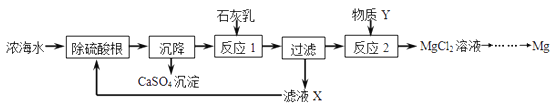
(1)写出反应2的化学方程式:_________________________________________。
(2)操作流程中可循环使用的物质是___________(填化学式)。
(3)在实验室如何证明溶液中的SO42﹣已完全沉淀:_____________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,0.1 mol Na2CO3与盐酸混合所得的一组体积为1 L的溶液,溶液中部分微粒与pH 的关系如下图所示。下列有关叙述正确的是

A. 随pH增大,![]() 数值先减小后增大
数值先减小后增大
B. b点所示的溶液中:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(Cl-)+c(HCO3- )
C. 25℃时,碳酸的第一步电离常数Ka1=10-7
D. 溶液呈中性时:c(HCO3- )>c(CO32-)>c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究 H2O2、SO2、Br2 氧化性强弱,某小组同学设计如下实验(夹持及尾气处理装置已略去,气密性已检验)
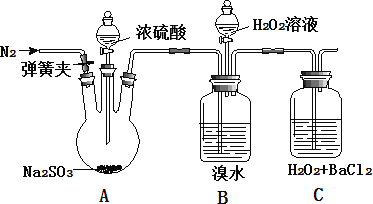
实验操作 | 实验现象 |
i. 打开 A 中分液漏斗活塞,滴加浓硫酸 | A 中有气泡产生,B 中红棕色褪色,C 中有白色沉淀 |
ii. 取 C 中沉淀加入盐酸 | C 中白色沉淀不溶解 |
iii. 打开B 中分液漏斗活塞,逐滴滴加H2O2 | 开始时颜色无明显变化;继续滴加 H2O2 溶液,一段时间后,混合液逐渐变成红棕色 |
(1)A 中发生反应的化学方程式是_____。
(2)B 中红棕色褪色的离子方程式是_____。
(3)甲同学通过 C 中产生白色沉淀,得出结论,氧化性:H2O2>SO2。C 中产生白色沉淀的离子方程式是_____。
①乙同学认为不能得出此结论, 认为在滴加浓硫酸之前应增加一步操作, 该操作是_____。
②丙同学认为还应该在 B 和 C 之间增加洗气瓶 D,D 中盛放的试剂是_____。
③将乙和丙同学改进后的方案进行实验,C 中产生白色沉淀,得出结论:氧化性 H2O2>SO2。
(4)iii 中滴入少量 H2O2 没有明显变化。提出假设:
观点 1:H2O2 的量少不能氧化溴离子
观点 2:B 中有未反应 SO2
为验证观点 2,应进行的实验操作及现象是_____。
(5)通过上述全部实验,得出结论:H2O2、SO2、Br2 氧化性由强到弱的顺序是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学拟用煤干馏的产物W为基本原料合成一系列化工产品,其流程如下(部分产物和条件省略):
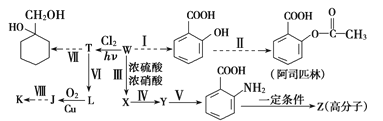
己知部分信息如下:
①1mol芳香烃W含50mol电子;
②![]()
③![]() (苯胺,易被氧化)
(苯胺,易被氧化)
④K的分子式为C7H6O2,其核磁共振氢谱上有4个峰。
请回答下列问题:
(1)Y的名称为_______,反应Ⅳ的反应类型为__________。
(2)反应Ⅲ的化学方程式为___________
(3)J的分子式为_____________
(4)Z的结构简式为__________
(5)K的同分异构体M既能发生水解反应,又能发生银镜反应,M在氢氧化钠溶液中发生水解反应的化学方程式为_________
(6)L的同分异构体中,能和氯化铁溶液发生显色反应的有_______种。
(7)补充步骤Ⅶ流程:(仿照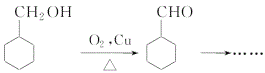 )_______
)_______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com