
| 消耗0.04mol/LHCl的体积(mL) | |||
| 三次实验 | 17.88 | 18.00 | 18.12 |
| ||
| 0.2L |
| 17.88+18.00+18.12 |
| 3 |
| 1 |
| 2 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:山东省莘县实验高中2010届高三上学期模拟考试化学试题 题型:022
| |||||||||||||||||||||||||||||||||||||
查看答案和解析>>
科目:高中化学 来源:2009年甘肃省河西五市二十校高三第一次联考化学试题人教版 人教版 题型:058
| |||||||||||||||||||||||||||||||||||||
查看答案和解析>>
科目:高中化学 来源: 题型:
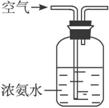
完成下列问题:
(1)实验时,A、C两装置均需加热,应先加热_________装置,原因是______________________。
(2)D装置中应填充的物质是_________,该物质的主要作用是__________________________。
(3)E装置的作用是__________________,F、G装置中的物质分别是____________________。
(4)若保留上图中黑色粗线框内的装置,但去掉通空气的导管B,将C装置中的双孔橡皮塞换成单孔橡皮塞,请你用图示的方法设计一个最简单的实验方案同样完成硝酸的制取(在下面的方框中画出装置图并注明所用药品的名称)。

查看答案和解析>>
科目:高中化学 来源:2012年鲁科版高中化学选修6 4.2 实验室制备化工原料练习卷(解析版) 题型:填空题
硝酸是一种重要的化工原料,工业上通常采用氨氧化法制取。某校化学兴趣小组的同学以氯化铵和氢氧化钙为主要原料并设计了下列装置来制硝酸(三氧化二铬为催化剂,加热及夹持装置未画出):
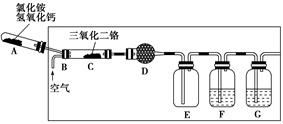
回答下列问题:
(1)实验时,A、C两装置均需加热,应先加热________装置,原因是
________________________________________________________________________。
(2)D装置中应填充的物质是________,该物质的主要作用是____________________。
(3)E装置的作用是__________________,F、G装置中的物质分别是________、________。
(4)若保留上图中黑色粗线框内的装置但去掉通空气的导管B,将C装置中的双孔橡皮塞换成单孔橡皮塞,请你用图示的方法设计一个最简单的实验方案同样完成硝酸的制取(在下面的方框中画出装置图并注明所用药品的名称)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com