
A、海水
| |||||||
B、海水
| |||||||
C、海水
| |||||||
D、海水
|
| ||


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:
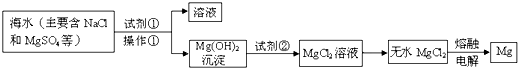
查看答案和解析>>
科目:高中化学 来源: 题型:


| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、上述变化包括了分解反应、化合反应、复分解反应类型 | B、贝壳烧成生石灰属于放热反应 | C、在氯化氢热气流中干燥晶体的目的是为了抑制阳离子的水解 | D、步骤⑤也可以采用电解该盐水溶液的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:
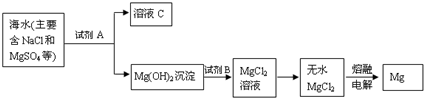
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com