
���� A��B��C��DΪ��ѧ���������Ҿ�����ͬһ��Ԫ�أ��������и�����ת����ϵ��A�ܾ�������������C��C��ˮ��Ӧ����D��
��1����A��B��C��D��Ϊ������������ǵ�ˮ��Һ����ʹʪ�����ɫʯ����ֽ��죬���ǵ�ˮ��Һ�������ԣ���AΪH2S��BΪSO2��CΪSO3��DΪH2SO4��
��2����A��ˮ��Һ��ʹʪ��ĺ�ɫʯ����ֽ��������AΪNH3��D��ϡ��Һ��ʹʪ�����ɫʯ����ֽ��죬D�����ԣ���BΪNO��CΪNO2��DΪHNO3��
��3����AΪǰ18��Ԫ���е�ij�ֽ������ʣ�DΪǿ���AΪNa��BΪNa2O��CΪNa2O2��DΪNaOH���ݴ˴��⣮
��� �⣺A��B��C��DΪ��ѧ���������Ҿ�����ͬһ��Ԫ�أ��������и�����ת����ϵ��A�ܾ�������������C��C��ˮ��Ӧ����D��
��1����A��B��C��D��Ϊ������������ǵ�ˮ��Һ����ʹʪ�����ɫʯ����ֽ��죬���ǵ�ˮ��Һ�������ԣ���AΪH2S��BΪSO2��CΪSO3��DΪH2SO4��B��C�Ļ�ѧ����ʽΪ2SO2+O2$?_{��}^{����}$2SO3 ��
�ʴ�Ϊ��H2SO4��2SO2+O2$?_{��}^{����}$2SO3��
��2����A��ˮ��Һ��ʹʪ��ĺ�ɫʯ����ֽ��������AΪNH3��D��ϡ��Һ��ʹʪ�����ɫʯ����ֽ��죬D�����ԣ���BΪNO��CΪNO2��DΪHNO3��
ͨ�����Ϸ���֪��CΪNO2��A����B�ķ���ʽΪ4NH3+5O2$\frac{\underline{����}}{��}$4NO+6H2O��
�ʴ�Ϊ��NO2��4NH3+5O2$\frac{\underline{����}}{��}$4NO+6H2O��
��3����AΪǰ18��Ԫ���е�ij�ֽ������ʣ�DΪǿ���AΪNa��BΪNa2O��CΪNa2O2��DΪNaOH��
ͨ�����Ϸ���֪��BΪNa2O��C��D�Ļ�ѧ����ʽ��2Na2O2+2H2O�T4NaOH+O2����
�ʴ�Ϊ��Na2O��2Na2O2+2H2O�T4NaOH+O2����
���� ������Na��N��SԪ�ؼ��仯����Ϊ���忼�������ƶϣ�Ϊ��Ƶ���㣬��ȷ�������ʼ�����֮���ת���ǽⱾ��ؼ���ע�����ʵ������ԣ�ע���������ܱ��������ɹ������ƣ�Ϊ�״��㣮


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��100�桢101 kPa�����£�Һ̬ˮ��������Ϊ40.69 kJ•mol-1����H2O��g��?H2O��l�� �ġ�H=40.69 kJ•mol-1 | |||||||||||
| B�� | Li��Be��B����Ԫ�صĵ�һ�����ܣ�I1�����I2���ܴ�������ԭ��������ʧȥ�ڶ������ӵ���Be | |||||||||||
| C�� | ��֪��
 �ġ�HΪ-384 kJ•mol-1 �ġ�HΪ-384 kJ•mol-1 | |||||||||||
| D�� | ����NH5������ԭ�ӵ�����������2����8�����ӵ��ȶ��ṹ������ˮ��Ӧ�Ļ�ѧ����ʽΪNH5+H2O�TNH3•H2O+H2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �϶���Fe2+��������Fe3+ | B�� | ֻ��Fe2+��û��Fe3+��Cu2+ | ||
| C�� | ������Fe3+��������Cu2+ | D�� | �϶���Fe2+��������Fe3+��Cu2+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
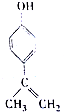
| A�� | �����ʵķ���ʽ��C9H11O | |
| B�� | �����ʷ����е�����Cԭ�ӿ��Թ��� | |
| C�� | ����KMnO4��H+����Һ���ɹ۲쵽��ɫ��ȥ����֤���ṹ�д���̼̼˫�� | |
| D�� | 1mol�����ʷֱ���Ũ��ˮ��H2��Ӧʱ���������Br2��H2�ֱ���3mol��4mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ֱ��С��1nm | B�� | �����������˶� | ||
| C�� | ����������� | D�� | ���������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.1 mol•L-1��Na2CO3��Һ������Ũ�ȹ�ϵ��c ��Na+��=2c ��CO32-��+c ��HCO3-��+c ��H2CO3�� | |
| B�� | 0.1 mol•L-1��NH4Cl��0.1 mol•L-1��NH3•H2O�������Ϻ���Һ�е�����Ũ�ȹ�ϵ��c ��Cl-����c ��NH4+����c ��H+����c ��OH-�� | |
| C�� | �����£���������Һ�еμ���������ʹ��Һ��pH=7��������Һ�У�����Ũ�ȹ�ϵ��c ��Na+��=c ��CH3COO-�� | |
| D�� | 0.1 mol•L-1��NaHS��Һ������Ũ�ȹ�ϵ��c ��OH-��=c ��H+��-c ��S2-��+c ��H2S�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | O2-��ȼ���� | B�� | NaOH-������ | C�� | ϡHNO3-��ȼ���� | D�� | Ũ����-��ʴƷ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com