
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是
( )

A.非金属性:Z<T<X
B.R与Q的电子数相差26
C.气态氢化物稳定性:R<T<Q
D.最高价氧化物的水化物的酸性:T>Q
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
研究下表信息可直接得出的结论是 ( )
| 元素 | F | Cl | Br | I |
| 氢化物组成 | HF | HCl | HBr | HI |
| 氢化物形成难 易程度 | H2、F2混合,冷暗处剧烈化合并发生爆炸 | H2、Cl2混合,光照或点燃时发生爆炸 |
| H2、I2混合,加热化合,同时又分解 |
| 氢化物热稳定性 | 很稳定 | 稳定 | 较稳定 | 较不稳定 |
A.元素性 质随原子序数的递增而呈周期性变化
质随原子序数的递增而呈周期性变化
B.同周期元素的非金属性随原子序数递增而增强
C.第ⅦA族元素的金属性随电子层数增加而减弱
D.第ⅦA族元素的非金属性随电子层数增加而减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
I、某实验小组同学为了探究铜与浓硫酸的反应,进行了如下系列实验,实验装置如图所示:
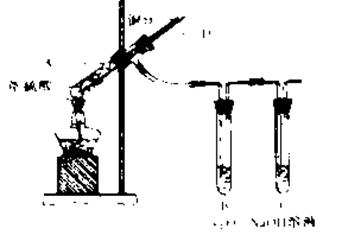
实验步骤:
①先连接好装置,检查气密性,加入试剂;
②加热A试管直到B中品红褪色,熄灭酒精灯;
③将Cu丝上提离开液面。
(1)装置A中发生反应的化学方程式为____________________.
(2)拆除装置前,不需打开胶塞,就可使装置中残留气体完全被吸收,应当采取的操作是_________________.
(3)若将B中品红溶液换成溴水,通入一段时间后溴水褪色,这说明了二氧化硫具有漂白性,你是否同意这个观点___________,(填“同意”或“不同意”),说明理由_________(用离子方程式表示)。
II、以浓硫酸、浓硝酸、粗铜、水和空气为原料可制得硫酸铜晶体。其过程如下图所示。
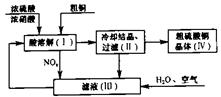
回答下列问题:
(4)配平在滤液(III)中发生反应的化学方程式:
_____NOx+____H2O+___O2=____HNO3
(5)写出制取硫酸铜的总反应方程式:_______________________.
(6)在上述生产过程中,被循环使用的物质是________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是元素周期表的一部分,完成以下有关问题。
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
(1)写出下列元素符号:
① ;⑥ ;⑦ ;⑪ 。
(2)在这些元素中,最活泼的金属元素是 ;最活泼的非金属元素是 ;最不活泼的元素是 。
(3)在这些元素的最高价氧化物对应的水化物中,酸性最强的是 ;碱性最强的是 ;呈两性的氢氧化物是 ;写出三者之间相互反应的化学方程式
;
;
。
(4)在这些元素中,原子半径最小的是 ;原子半径最大的是 。
(5)④和⑧形成的化合物中含有的化学键类型是 ;其电子式为 。
(6)在⑧和⑫中,非金属性较强的是 ;写出能体现非金属性强弱的一个化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
元素A的阳离子aAm+与元素B的阴离子bBn-具有相同的电子层结构。以下关于A、B元素性质的比较中,正确的是 ( )
①原子序数:A>B
②离子半径:aAm+<bBn-
③原子半径:A<B
④元素所在的周期序数:A>B
⑤A的最高正价与B的最低负价的绝对值相等
⑥b=a+m-n
A.②③④ B.①②④
C.④⑤⑥ D.②⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是元素周期表的一部分。
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 1 | ① | ||||||
| 2 | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(1)表中原子半径最小的元素符号是 ;
(2)表中氧化性最强的单质的化学式为 ;
(3)表中最高价氧化物的水化物中碱性最强的物质的化学式是 ,酸性最强的物质的化学式是________________________________;
(4)④⑤⑥三种元素中,离子半径大小的顺序为 > >
(填离子符号);
(5)③⑦⑧三种元素的气态氢化物的稳定性强弱顺序为 >
> (填化学式);
(6)元素②的氢化物与元素⑧的氢化物反应的化学方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
不同的金属,其冶炼方法可能不同,主要原因是( )
A.金属的活动性不同
B.金属在自然界中的分布不同
C.金属在自然界中的存在形式不同
D.金属在自然界中的含量不同
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验的有关叙述正确的是 ( )
A.用浓硫酸与蛋白质的颜色反应鉴别部分蛋白质
B.用食醋浸泡有水垢的水壶清除其中的水垢
C.用乙醇和浓硫酸除去乙酸乙酯中的少量乙酸
D.用乙醇从碘水中萃取碘
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是 ( )
①离子化合物一定含离子键,也可能含共价键
②共价化合物可能含离子键
③含金属元素的化合物不一定是离子化合物
④由非金属元素组成的化合物一定是共价化合物
⑤由分子组成的物质中一定存在化学键
⑥熔融状态能导电的化合物一定是离子化合物
A.①③⑤ B.②④⑥ C.②③④ D.①③⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com