
一种新药物结构如图所示,下列有关说法正确的是( )
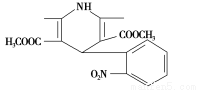
A.该化合物的分子式为C17H17N2O6
B.该化合物的分子中含有三种不同的官能团
C.该化合物的不饱和度为10
D.该化合物能发生水解反应、聚合反应、取代反应、消去反应
科目:高中化学 来源:2015-2016学年广东汕头金山中学高二上10月月考化学卷(解析版) 题型:选择题
某温度下,将3molA和3molB充入体积为 1L的密闭容器中,发生如下反应:aA(g)+2B(g)?3C(g)+D(g).反应达到平衡后,C的浓度为 3mol/L.压缩容器体积,使容器的体积减小一半,建立新的平衡时,B的浓度为2mol/L.则方程式中a的数值为( )
A.1 B.2 C.3 D.4
查看答案和解析>>
科目:高中化学 来源:2016届浙江省高三上学期期中考试化学试卷(解析版) 题型:选择题
分析下表,下列选项中错误的是
化学式 | NH3·H2O | CH3COOH | HCN | H2CO3 |
电离平衡常数(25℃) | 1.8×l0—5 | 1.8×l0—5 | 4.9×l0—10 | K1= 4.3×l0—7, K2= 5.6×l0—11 |
A.0.1mol·L-1 CH3COONa 溶液显碱性,0.1mol·L-1 CH3COONH4 溶液显中性
B.等物质的量浓度的NaHCO3和NaCN溶液,前者溶液中水的电离程度大
C.NaCN + H2O + CO2 (少量) = HCN + NaHCO3
D.上述3种等体积等pH的酸溶液,分别加水稀释后pH仍相等,则醋酸中加入水的体积最少
查看答案和解析>>
科目:高中化学 来源:2016届浙江绍兴市高三上学期期中考试化学试卷(解析版) 题型:选择题
a mol FeS与b mol FeO投入到v L、c mol•L-1的硝酸溶液中充分反应,产生NO气体,所得澄清溶液的成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为
①(a+b)×63g ②(a+b)×189g ③(a+b)mol ④[cV-(9a+b)/3 ]mol
A.①④ B.②③ C.①③ D.②④
查看答案和解析>>
科目:高中化学 来源:2015-2016学年重庆市高一上期中测试化学试卷(解析版) 题型:选择题
已知硫酸铅难溶于水也能溶于酸,却可溶于醋酸铵(NH4Ac,Ac-表示醋酸根离子,HAc表示醋酸)溶液形成无色溶液,其化学方程式是:PbSO4+2NH4Ac=Pb(Ac)2+(NH4)2SO4.当Pb(Ac)2(醋酸铅)溶液中通入H2S时,有黑色沉淀PbS生成.表示这种黑色PbS生成的反应的方程式正确的是( )
A.Pb2++H2S=PbS↓+2H+ B.Pb(Ac)2+H2S=PbS↓+2Hac
C.Pb2++2Ac-+H2S=PbS↓+2HAc D.Pb2++2Ac-+2H++S2-=PbS↓+2HAc
查看答案和解析>>
科目:高中化学 来源:2016届云南玉溪第一中学高三上学期期中考试理化学试卷(解析版) 题型:实验题
高纯MnCO3是制备高性能磁性材料的主要原料。实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下:
(1)制备MnSO4溶液:在烧瓶中(装置见右图)加入一定量MnO2和水,搅拌,通入SO2和N2混合气体,反应3h。停止通入SO2,继续反应片刻,过滤.
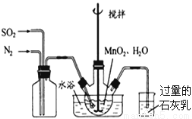
① 写出左边集气瓶的作用 。
② 石灰乳的作用是: (用化学方程式表示)
③ 写出MnO2和H2SO3反应的离子反应方程式 。
④反应过程中,为使SO2尽可能转化完全,在通入SO2和N2比例一定、不改变固液投料的条件下,可采取的合理措施有 (选择选项填空)。
a.缓慢通入混合气体 b.快速通入混合气体c.控制适当的温度 d.高温加热
(2)制备高纯MnCO3固体:已知MnCO3难溶于水、乙醇,潮湿时易被空气氧化, 100℃开始分解;Mn(OH)2开始沉淀时pH=7.7。请补充由(1)制得的MnSO4制备高纯MnCO3的操作步骤【实验中可选用的试剂: Ca(OH)2、NaHCO3、Na2CO3、C2H5OH】。
100℃开始分解;Mn(OH)2开始沉淀时pH=7.7。请补充由(1)制得的MnSO4制备高纯MnCO3的操作步骤【实验中可选用的试剂: Ca(OH)2、NaHCO3、Na2CO3、C2H5OH】。
① 边搅拌边加入Na2CO3,并控制溶液pH<7.7;
② ;
③ 检验SO42-是否被洗涤干净。检验水洗是否合格的方法是 。
④ 用少量C2H5OH洗涤,其目的是 ;
⑤ 低于1 00℃干燥。
00℃干燥。
查看答案和解析>>
科目:高中化学 来源:2016届江西师大附中,九江一中高三上期中化学试卷(解析版) 题型:实验题
甲酸(HCOOH)是一种有刺激性气味的无色液体,有很强的腐蚀性。熔点8.4℃,沸点100.7℃,能与水、乙醇互溶,加热至160℃即分解成二氧化碳和氢气。
(1)实验室可用甲酸与浓硫酸共热制备一氧化碳:HCOOH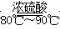 H2O+CO↑,实验的部分装置如下图所示。制备时先加热浓硫酸至80℃~90℃,再逐滴滴入甲酸。
H2O+CO↑,实验的部分装置如下图所示。制备时先加热浓硫酸至80℃~90℃,再逐滴滴入甲酸。
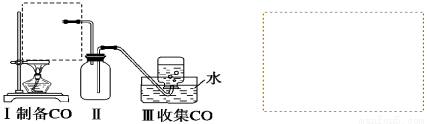
①从下图挑选所需的仪器,在虚线框中画出Ⅰ中所缺的气体发生装置(添加必要的塞子、玻璃管、胶皮管,固定装置不用画),并标明容器中的试剂。
②装置Ⅱ的作用是_____________________________________________。
(2)实验室可用甲酸制备甲酸铜。其方法是先用硫酸铜和碳酸氢钠作用制得碱式碳酸铜,然后再与甲酸制得四水甲酸铜[Cu(HCOO)2·4H2O]晶体。相关的化学方程式是:
2CuSO4+4NaHCO3===Cu(OH)2·CuCO3↓+3CO2↑+2Na2S O4+H2O
O4+H2O
Cu(OH)2·CuCO3+4HCOOH+5H2O===2Cu(HCOO)2·4H2O+CO2↑
实验步骤如下:
I.碱式碳酸铜的制备:

①步骤ⅰ是将一定量CuSO4·5H2O晶体和 NaHCO3固体一起放到研钵中研磨,其目的是___________。
NaHCO3固体一起放到研钵中研磨,其目的是___________。
②步骤ⅱ是在搅拌下将固体混合物分多次缓慢加入热水中,反应温度控制在70℃~80℃,如果看到______(填写实验现象),说明温度过高。
II.甲酸铜的制备:
将Cu(OH)2·CuCO3固体放入烧杯中,加入一定量热的蒸馏水,再逐滴加入甲酸至碱式碳酸铜恰好全部溶解,趁热过滤除去少量不溶性杂质。在通风橱中蒸发滤液至原体积的1/3时,冷却析出晶体,过滤,再用少量无水乙醇洗涤晶体2—3次,晾干,得到产品。
a、“趁热过滤”中,必须“趁热”的原因是 。
b、用乙醇洗涤晶体的目的是 。
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三上学期期中考试化学试卷(解析版) 题型:选择题
下列有关叙述中正确的是
A.19%的MgCl2溶液中,Cl-与H2O个数比为4:45
B.为检验酸性溶液中的Cl-和SO42-,先加稀硝酸银溶液,滤去沉淀后滤液中加硝酸钡溶液
C.S8和NO2都是共价化合物,NH4Cl和CaC2都是离子化合物
D.若ⅡA某元素的原子序数为m,则同周期ⅢA元素的原子序数有可能为m+10
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高三上学期12月月考化学试卷(解析版) 题型:选择题
能正确表示下列反应的离子方程式是( )
A.AlCl3溶液中加入过量稀氨水:Al3++4NH3·H2O AlO2- +4NH4+ +2H2O
AlO2- +4NH4+ +2H2O
B.碳酸氢铵溶液中加入足量氢氧化钡溶液: NH4++HCO3﹣+2OH- CO32﹣+ NH3·H2O + H2O
CO32﹣+ NH3·H2O + H2O
C.Cu溶液于稀HNO3:3Cu+8H++2NO3- =3Cu2++2NO↑+4H2O
D.用铜电极电解饱和食盐水:2Cl-+2H2O  Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com