
【题目】常温下,部分酸的电离平衡常数如下:
化学式 | HK | HCN | H2CO3 |
电离常数 | Ka=3.5×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7,Ka2=5.6×10-11 |
(1)c (H+)相同的三种酸,其酸的浓度从大到小为____________________。
(2)若HCN酸的起始浓度为0.0lmol/L,平衡时c(H+)约为____________mol/L。
若使此溶液中HCN的电离程度增大且c(H+)也增大的方法是____________。
(3)中和等量的NaOH,消耗等pH的氢氟酸和硫酸的体积分别为aL、bL,则a______b (填“大于”、“小于”或“等于”)。中和等浓度、等体积的氢氟酸和硫酸需要NaOH的物质的量为n1、n2,则n1_________n2 (填“大于”、“小于”或“等于”)
(4)向NaCN中通入少量的CO2,发生的离子方程式为_________________________。
(5)设计实验证明氢氟酸比盐酸的酸性弱___________________________________________________。
【答案】 c(HCN)>c (H2CO3) >c(HF) ![]() ×10-6 升高温度 小于 小于 CN-+CO2+H2O=HCN+HCO3- 测定等浓度的两种酸的pH,氢氟酸的pH大或等浓度的两种酸分别与Zn反应,初始氢氟酸冒气泡慢 (其它合理也给分)
×10-6 升高温度 小于 小于 CN-+CO2+H2O=HCN+HCO3- 测定等浓度的两种酸的pH,氢氟酸的pH大或等浓度的两种酸分别与Zn反应,初始氢氟酸冒气泡慢 (其它合理也给分)
【解析】(1)根据三种酸的电离平衡常数可知,酸性:HF>H2CO3>HCN>HCO3-。因此c (H+)相同的三种酸,其酸的浓度从大到小的顺序为c (HCN)>c (H2CO3) >c (HF),故答案为:c (HCN)>c (H2CO3) >c (HF);
(2)设c(H+)=x,根据HCN![]() H++CN-,Ka=5.0×10-10=
H++CN-,Ka=5.0×10-10=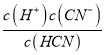 =
=![]() ,解得x≈
,解得x≈![]() ×10-6,弱电解质的电离过程是吸热过程,升高温度,能够促进HCN的电离,电离程度增大,c(H+)也增大,故答案为:
×10-6,弱电解质的电离过程是吸热过程,升高温度,能够促进HCN的电离,电离程度增大,c(H+)也增大,故答案为: ![]() ×10-6;升高温度;
×10-6;升高温度;
(3)中和等量的NaOH,需要消耗等物质的量的氢离子,当氢氟酸和硫酸的pH相等时,由于硫酸是强酸,氢氟酸为弱酸,需要氢氟酸和硫酸的体积比小于1:1,即a小于b。氢氟酸为一元酸、硫酸为二元酸,中和等浓度、等体积的氢氟酸和硫酸需要NaOH的物质的量为1:2,即n1小于n2,故答案为:小于;小于;
(4)酸性:HF>H2CO3>HCN>HCO3-。向NaCN中通入少量的CO2反应生成HCN和NaHCO3,反应的离子方程式为CN-+CO2+H2O=HCN+HCO3-,故答案为:CN-+CO2+H2O=HCN+HCO3-;
(5)证明氢氟酸比盐酸的酸性弱可以使用的方法有:①测定等浓度的两种酸的pH,氢氟酸的pH大;②等浓度的两种酸分别与Zn反应,初始氢氟酸冒气泡慢;③测定等物质的量浓度的两种溶液的导电性,盐酸的灯泡较亮、氢氟酸的灯泡较暗等,故答案为:测定等浓度的两种酸的pH,氢氟酸的pH大或等浓度的两种酸分别与Zn反应,初始氢氟酸冒气泡慢。


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
【题目】下列各组离子能大量共存,且强酸性溶液中也能大量共存的一组是
A. K+、Na+、ClO―、SO42― B. Mg2+、Al3+、NO3―、SO42―
C. Na+、CO32―、Cu2+、K+ D. Fe2+、K+、Cl―、NO3―
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,浓度都是1mol·L﹣1的两种气体X2和Y2,在密闭容器中发生反应生成气体Z,反应2min后,测得参加反应的X2的浓度为0.6mol·L﹣1,用Y2的浓度变化表示的化学反应速率v(Y2)=0.1mol·L﹣1·min﹣1,生成的c(Z)为0.4mol/L.则该反应的化学方程式是( )
A. X2+2Y2![]() 2Z B. 2X2+Y2
2Z B. 2X2+Y2![]() 2Z C. 3X2+Y2
2Z C. 3X2+Y2![]() 2Z D. X2+3Y2
2Z D. X2+3Y2![]() 2Z
2Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(As)是第33号元素,可以形成As2S3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。回答下列问题:
(1)砷在元素周期表中的位置是__________________________。
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式_________________________________________。该反应需要在加压下进行,原因是__________________________。
(3)已知:2As(s)+3H2(g)+4O2(g)=2H3AsO4(s)△H1
H2(g)+ ![]() O2(g)=H2 O(l) △H2
O2(g)=H2 O(l) △H2
2As(s)+ ![]() O2(g) =As2O5(s)△H3
O2(g) =As2O5(s)△H3
则反应 As2O5(s) +3H2O(1)= 2H3AsO4(s)的△H=____________。
(4)298K时,将20mL3xmol·L-1Na3AsO3、20 mL 3xmol·L-1I2和20mL NaOH溶液混合,发生反应:AsO33-(aq)+I2+2OH-![]() AsO43-+2I-+H2O。溶液中c(AsO43-) 与反应时间(t)的关系如图所示。
AsO43-+2I-+H2O。溶液中c(AsO43-) 与反应时间(t)的关系如图所示。

①下列不能判断反应达到平衡的是________(填标号)。
a.溶液的pH不再变化 b.v(I-)=2v(AsO33-)
c.c(AsO43-)/c(AsO33-)不再变化 d.c(I-)=ymol·L-1
②tm时v逆 ______tn时v逆(填“>”“<”或“=”),理由是_____________。
③若平衡时溶液的c(OH-)=lmol/L,则该反应的平衡常数K为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2 L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示。
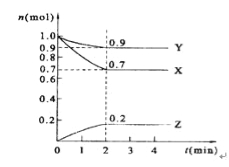
(1)X的转化率是
(2)由图中所给数据进行分析,该反应的化学方程式为 ;
(3)反应从开始至2分钟末,用Z的浓度变化表示的平均反应速率为v(Z)= ,
(4)当反应进行到第 min,该反应达到平衡。若三种物质都是气体,平衡时Y所占体积的百分比为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程中,能量转化的主要方式不正确的是( )
A.硅太阳能电池工作时,光能转化成电能
B.铅蓄电池充电时,化学能转化成电能
C.电解质溶液导电时,电能转化成化学能
D.植物进行光合作用时,光能转化成化学能
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com