
| A. | 木材纤维和土豆淀粉遇碘水均显蓝色 | |
| B. | 食用花生油和鸡蛋清都能发生水解反应 | |
| C. | 包装用材料聚乙烯和聚氯乙烯都属于烃 | |
| D. | 经常使用一次性筷子、纸杯、塑料袋等做法能保护环境 |
分析 A.淀粉遇碘水显蓝色;
B.食用花生油成分是油脂,鸡蛋清成分是蛋白质;
C.烃是指仅含碳氢两种元素的化合物;
D.一次性筷子浪费木材,纸杯与塑料袋等对环境造成污染.
解答 解:A.淀粉遇碘水显蓝色,纤维素遇碘水不显蓝色,木材纤维的主要成分是纤维素,故A错误;
B.食用花生油成分是油脂,鸡蛋清成分是蛋白质,油脂水解生成高级脂肪酸和甘油,蛋白质水解生成氨基酸,故B正确;
C.聚氯乙烯还含有氯元素,故C错误;
D.经常使用一次性筷子和纸杯,会消耗大量的木材,一次性塑料袋的大量使用会造成白色污染,故措施不合理,故D错误;
故选B.
点评 本题考查有机物的性质与简单分类,比较基础,明确环保的意义是关键.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “光化学烟雾”、“硝酸型酸雨”的形成都与氮氧化合物有关 | |
| B. | SiO2可用于制造光导纤维,其性质稳定,不溶于强酸、强碱 | |
| C. | 根据分散质微粒直径大小可以将分散系分为溶液、胶体和浊液 | |
| D. | 焰火的五彩缤纷是某些金属元素的性质的表现 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
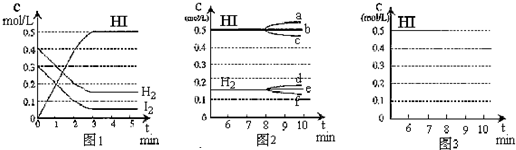
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 负极的电极反应式是:CH3OH-6e-+8OH-═CO32-+6H2O | |
| B. | 乙中A极析出的气体在标准状况下的体积为1.12 L | |
| C. | 右图中②线表示的是Fe2+离子的变化 | |
| D. | 反应结束后,要使丙装置溶液中金属阳离子恰好完全沉淀,需要280 mL 5.0 mol/L NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在溶液中加KSCN,溶液显红色,证明原溶液中有Fe3+,无Fe2+ | |
| B. | 气体通过无水硫酸铜,粉末变蓝,证明原气体中含有水蒸气 | |
| C. | 灼烧白色粉末,火焰呈黄色,证明原粉末中有Na+,无K+ | |
| D. | 某溶液加入CCl4,CCl4层显紫色,证明原溶液中存在I- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  干燥Cl2 | |
| B. |  配制100 mL 0.1 mol•L-1 硫酸溶液 | |
| C. | 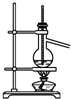 分离沸点相差较大的互溶液体混合物 | |
| D. | 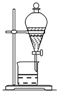 分离互不相溶的两种液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com