
| A. | V(酸)=102 V(碱) | B. | V(碱)=102 V(酸) | C. | V(酸)=2 V(碱) | D. | V(碱)=2 V(酸) |
分析 25℃时,Kw=10-14,某强酸溶液pH=a,则该酸溶液中氢离子浓度为10-a mol/L,强碱溶液pH=b,则碱溶液中氢氧根离子浓度=10 b-14 mol/L,混合后溶液的pH=7说明氢离子和氢氧根离子的物质的量相等,据此解答.
解答 解:25℃时,Kw=10-14,某强酸溶液pH=a,则该酸溶液中氢离子浓度为10-a mol/L,强碱溶液pH=b,则碱溶液中氢氧根离子浓度=10 b-14 mol/L,混合后溶液的pH=7说明氢离子和氢氧根离子的物质的量相等,设酸的体积为V(酸),碱的体积为V(碱),10-a mol/L×V(酸)L=10 b-14 mol/L×V(碱)L,则V(酸)=10 a+b-14 V(碱),而a+b=12,故V(碱)=100V(酸),故选B.
点评 本题考查了离子积常数的有关计算,根据溶液的酸碱性及水的离子积常数来分析解答,注意该温度下水的离子积常数是10-14,为易错点.


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:填空题
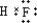 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡不移动 | |
| B. | 再达平衡时,n(A):n(B):n(C)仍为2:2:1 | |
| C. | 再达平衡时,C的体积分数增大 | |
| D. | 若将容器改为恒压容器,则平衡向右移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 该溶液c(H+)≥0.1 mol/L | |
| B. | 把该溶液稀释成1 L后,pH≥2 | |
| C. | 把该溶液稀释成1 L后,pH≤2 | |
| D. | 中和此溶液需0.1mol/L的NaOH体积≥100mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴定管用蒸馏水洗涤后,装入NaOH溶液进行滴定 | |
| B. | 随着NaOH溶液滴入,锥形瓶中溶液pH由小变大 | |
| C. | 用酚酞作指示剂,当锥形瓶中溶液由红色变无色时停止滴定 | |
| D. | 滴定终点时,发现滴定管尖嘴部分有悬滴,则测定结果偏小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com