
实验室中的药品常按物质的性质、类别等有规律地摆放。现有部分药品按某种规律摆放在实验桌上,如下图。做实验时,某同学取用硝酸溶液后,应把它放回的位置是

科目:高中化学 来源:2016届陕西省高三上学期第二次模拟理综化学试卷(解析版) 题型:选择题
下列实验能达到预期目的的
选项 | 实验内容 | 实验目的 |
A | 测定等物质的量浓度的Na2SO3与Na2CO3溶液的pH,后者较大。 | 证明了非金属性S>C |
B | 某溶液中加入少量双氧水,再加几滴KSCN溶液后变红 | 可以证明原溶液中一定含Fe2+ |
C | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体,溶液红色会变浅。 | 可以证明Na2CO3溶液中存在水解平衡。 |
D | 取两只试管,分别加入4ml 0.01mol/L KMnO4酸性溶液,然后向一只试管中加入0.1mol/L H2C2O4溶液2ml,向另一只试管中加入0.1mol/L H2C2O4溶液4ml,记录褪色时间。 | 可以证明H2C2O4浓度越大反应速率越快。 |
查看答案和解析>>
科目:高中化学 来源:2015-2016学年上海市高二上学期期中测试化学试卷(解析版) 题型:选择题
主族元素R的最高价氧化物的化学式为R2O5,则它的气态氢化物的化学式是:
A.RH4 B.RH3 C.H2R D.HR
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江台州中学高二上第三次统练化学试卷(解析版) 题型:简答题
氨气是重要化工产品之一。传统的工业合成氨技术的反应原理是:
N2(g)+3H2(g)  2NH3(g) ΔH=-92.4 kJ/mol。在500 ℃、20 MPa时,将N2、H2置于一固定容积的密闭容器中反应,反应过程中各种物质的量变化如图所示,回答下列问题:
2NH3(g) ΔH=-92.4 kJ/mol。在500 ℃、20 MPa时,将N2、H2置于一固定容积的密闭容器中反应,反应过程中各种物质的量变化如图所示,回答下列问题:

(1)计算反应在第一次平衡时的平衡常数K= 。(保留二位小数)
(2)由第一次平衡到第二次平衡,平衡移动的方向是 ,采取的措施是 。
(3)45 min时刻改变的条件是 。
(4)产物NH3在5~10 min、25~30min和45~50 min时平均反应速率从大到小的排列次序为 (平均反应速率分别以v1、v2、v3表示)。
(5)随着条件的改变,达到三次平衡时H2的转化率也发生[了变化,如分别以α1、α2、α3表示,其中最小的是 。
(6)请在图中用实线表示25~45、45~60min 两阶段化学平衡常数K的变化图像。

查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西大学附属中学高一上期中化学试卷(解析版) 题型:填空题
KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯。反应的化学方程式为:2KClO3+4HCl(浓)===2KCl+2ClO2↑+Cl2↑+2H2O。
(1)将上述反应改写成离子方程式并分析电子转移的情况(双线桥法表示);
(2)浓盐酸在反应中显示出来的性质是__________(填写编号)。
①还原性; ②氧化性和还原性; ③氧化性; ④酸性
(3)已知浓盐酸的密度为1.18g/cm3,质量分数为36.5%,则该盐酸的物质的量浓度是 。
(4)ClO2具有很强的氧化性。因此,常被用作消毒剂(还原产物是Cl-),其消毒的效率(以单位质量得到的电子数表示)是Cl2的__________倍。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南衡阳第八中学高一上六科联赛化学卷(解析版) 题型:选择题
下列各组在溶液中进行的两个反应,可用同一离子方程式表示的是
A.CaCO3和HCl ;Na2CO3和HCl B.BaCl2 和H2SO4 ;Ba(OH)2和H2SO4
C.HCl 和Na2CO3 ;HCl和NaHCO3 D.KOH 和H2SO4;Ba(OH)2和HNO3
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南常德市高二12月月考化学卷(解析版) 题型:选择题
下列物质中属于高分子化合物的是()
①油脂、②蔗糖、③羊毛、④葡萄糖、⑤纤维素、⑥谷氨酸、⑦胃蛋白酶
A.①⑤⑦ B.②④⑥ C.③⑤⑦ D. ④⑤⑥
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省高三化学一诊模拟理综化学试卷(解析版) 题型:实验题
某课外活动小组设计了以下实验方案验证Ag与浓HNO3反应的过程中可能产生NO。其实验流程图如下:

(1)测定硝酸物质的量:反应结束后,从下图B装置中所得100 mL溶液中取出25.00 mL溶液,用0.1 mol·L -1 的NaOH溶液滴定,用酚酞作指示剂,滴定前后的滴定管中液面的位置如右上图所示。在B容器中生成硝酸的物质的量为__________,则Ag与浓硝酸反应过程中生成的NO2的物质的量为____________。
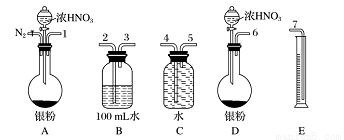
(2)测定NO的体积:①从上图所示的装置中,你认为应选用________装置进行Ag与浓硝酸反应实验,选用的理由是______________________。
②选用上图所示仪器组合一套可用来测定生成NO体积的装置,其合理的连接顺序是_____(填各导管口编号)。
③在读取量筒内液体体积之前,应进行的操作________________________________。
(3)气体成分分析:若实验测得NO的体积为112.0 mL(已折算到标准状况),则Ag与浓硝酸反应的过程中______________ (填“有”或“没有”)NO产生,作此判断的依据是_______________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南南阳第一中学高一上第二次月考化学卷(解析版) 题型:选择题
下列叙述中错误的是(用NA代表阿伏加德罗常数的值)
①46gNO2和N2O4的混合气体中含N原子总数为NA ;②用含0.1molFeCl3的溶液与足量沸水反应制得的Fe(OH)3胶体中胶粒数为0.1NA ;③7.8gNa2S和Na2O2的混合物中含有阴离子数大于0.1×6.02×1023 ;④标准状况下,22.4LH2O含有的分子数为NA ;⑤等物质的量的NH4+和OH-含电子数均为10NA
A.①②③④⑤ B. ①③④⑤ C. ②③④⑤ D. ③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com