
【题目】硝基苯可与金属Fe、盐酸反应生成苯胺和FeCl2,反应如下:
![]() +3Fe+6HCl
+3Fe+6HCl![]()
![]() +3FeCl2+2H2O
+3FeCl2+2H2O
(1)写出Fe2+基态核外电子排布式:_______。
(2)苯胺分子中C、N原子的杂化方式分别是________。1mol苯胺分子中含σ键的数目是___。
(3)苯胺与盐酸反应可生成氯化苯胺盐![]() ,氯化苯胺盐中含有的化学键有______。
,氯化苯胺盐中含有的化学键有______。
(4)苯胺在水中的溶解度大于硝基苯,其原因是________。
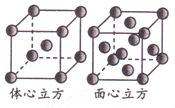
(5)金属铁单质的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。则两种晶胞中Fe原子的配位数之比为_______。
【答案】 [Ar]3d6 sp2 sp3 14NA 共价键、离子键、配位键(配位键可以不写) 苯胺分子与水分子间可以形成氢键 2:3
【解析】(1)铁是26号元素,其原子核外有26个电子,Fe原子的3d、4s电子为其价电子,则Fe2+核外有24个电子,排布式为[Ar]3d6,答案为:[Ar]3d6
(2)根据价层电子对互斥理论确定杂化类型,价层电子对个数=σ键个数+孤电子对,苯胺中碳原子杂化轨道数为3,所以采取sp2杂化,N元素全部形成单键,属于sp3杂化,单键都是σ键,1 mol苯胺分子中含σ键的数目是14NA故答案为:sp2 sp3,14NA
(3)氯化苯胺盐中含有共价键、离子键、配位键,故答案为:共价键、离子键、配位键。
(4)氢键比范德华力强,是一种介于化学键与分子间作用力之间的作用力,含F、O、N元素的物质中分子内或分子之间能形成氢键,苯胺在水中与水形成氢键,而硝基苯与水不能形成氢键,所以苯胺在水中的溶解度远大于硝基苯在水中的溶解度,故答案为:苯胺分子与水分子间可以形成氢键。
(5)体心立方晶胞中每个Fe原子周围有8个Fe原子,面心立方晶胞中,以顶点Fe原子为研究对象,与之最近的Fe原子处于面心,每个Fe原子周围有12个Fe原子,故体心立方晶胞和面心立方晶胞中Fe原子的配位数之比为8:12=2:3,故答案为:2:3.


 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:
【题目】常温下0.1mol/L的HCl和0.1mol/L的NaOH溶液等体积混合后,溶液pH( )
A. pH<7 B. pH> 7 C. pH=7 D. 无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A. 原电池中的负极失电子,发生还原反应
B. 原电池中发生氧化反应的电极是负极
C. 原电池中的电极一定要由两种不同的金属组成
D. 原电池中较活泼的金属做正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮酸钠(NaN3)是一种应用广泛的无色无味、可溶于水的晶体。已知:
物质 | CH3OH | N2H4 | NaN3 |
沸点/℃ | 64.7 | 113.5 | 300 |
(1)制备NaN3:
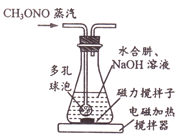
30℃时,水合肼(N2H4H2O)与亚硝酸甲酯(CH3ONO)、NaOH反应,装置如右图所示。反应后锥形瓶中混合物经“操作X”可回收CH3OH,母液降温结晶,过滤得NaN3粗品,重结晶得到NaN3产品。
①装置中的多孔球泡的作用是______。
②写出生成NaN3的化学方程式:_________________。
③“操作X”的名称为________________。
(2)测定NaN3产品纯度: ①称取NaN3产品5.0000g,用适量稀硫酸溶解后配成100.00mL溶液A;②取25.00mL溶液A,加入20.00mL0.2000mol/LKMnO4溶液,得紫红色溶液B;
③向溶液B加入足量KI溶液消耗过量的KMnO4溶液,然后以淀粉作指示剂,用0.1000mol/LNa2S2O3标准溶液滴定产生的I2,消耗Na2S2O3溶液30.00mL。测定过程中物质的转化关系如下:
10NaN3+2KMnO4+8H2SO4=2MnSO4+K2SO4+5Na2SO4+8H2O+15N2↑
I- ![]() I2
I2 ![]() S4O62-
S4O62-
计算NaN3产品的纯度(写出计算过程)。_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下① 6.72 L CH4 ② 3.01×1023个HCl分子 ③ 13.6 g H2S ④ 0.2mol NH3,下列对这四种气体的关系从大到小表达正确的是
a.体积②>③>①>④ b.密度②>③>④>① c.质量②>③>①>④ d.氢原子个数①>③>④>②
A. a b c B. a c d C. b c d D. a b c d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2FeSO4![]() Fe2O3+SO2↑+SO3↑。下列有关操作、装置、原理及对现象的表述正确的是
Fe2O3+SO2↑+SO3↑。下列有关操作、装置、原理及对现象的表述正确的是

A. 用装置甲高温分解FeSO4,点燃酒精喷灯前应先向装置内通一段时间N2
B. 用装置乙可检验分解产生的SO2,现象是石蕊试液先变红后褪色
C. 用装置丙可检验分解产生的SO3,现象是产生白色沉淀
D. 用装置丁可吸收尾气,避免污染环境
查看答案和解析>>
科目:高中化学 来源: 题型:
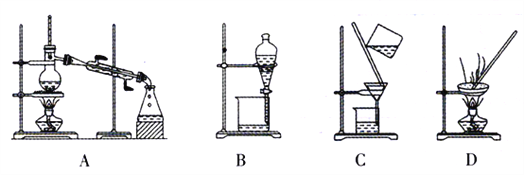
【题目】用下列实验装置进行相应实验,能达到实验目的的是

A. 用图1所示装置除去Cl2中含有的少量HCl
B. 用图2所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
C. 用图3所示装置制取少量纯净的CO2气体
D. 用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用只含有Al、Fe、Cu的工业废料制取氯化铝溶液、绿矾晶体(FeSO4·7H2O)和胆矾晶体(CuSO4·5H2O),以探索工业废料的再利用。其实验方案如下:
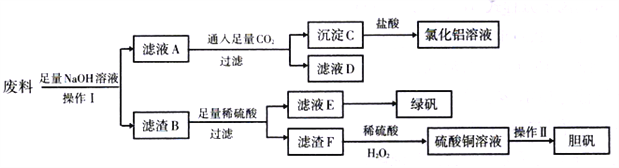
(1)操作I应选择以下装置中的_____________(填正确答案编号)。
(2)滤液D中的溶质主要是________________(写化学式)。
(3)写出沉淀C与盐酸反应的离子方程式:________________。
(4)滤液E露置在空气中一段时间后,检测出溶液中含Fe2+,原因是________________。
(5)写出滤渣F与稀硫酸、H2O2制硫酸铜的反应方程式_______________________,该反应与滤渣F跟浓硫酸直接反应相比,其优点是_________________________________。
(6)操作II步骤有蒸发浓缩、_______________、过滤洗涤、自然干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用20g氢氧化钠固体配成1 mol·L﹣1的NaOH溶液,所得溶液的体积是( )
A.1000 mL
B.500 mL
C.100 mL
D.50 mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com