

| A. | 保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍 | |
| B. | 保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 | |
| C. | 保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略) | |
| D. | 保持活塞位置不变,升高温度,达到新的平衡后,甲中B的体积分数增大,乙中B的体积分数减小 |
分析 开始加入4molC和2molD相当于起始加入2molA和4molB,即乙容器内的气体的物质的量为甲容器内的气体的物质的量的2倍,而乙容器的体积为甲容器的体积的2倍,在相同温度下达到相同平衡状态,平衡时同种物质的浓度相等,
A.保持温度和活塞位置不变,在甲中再加入1molA和2molB,则相当于在原来的基础上增大压强,平衡向逆反应方向移动,达到平衡时,甲中C的浓度小于原来的2倍;
B.保持温度不变,移动活塞P,使乙的容积和甲相等,则乙容器内的压强增大,平衡向逆反应方向移动;
C.甲温度和体积不变,加入氦气后对平衡移动没有影响,保持温度和乙中的压强不变,加入氦气后乙体积增大,平衡应向正反应方向移动,正逆反应速率都减小;
D.保持活塞位置不变,升高两个容器的温度,平衡向正反应方向移动.
解答 解:开始加入4molC和2molD相当于起始加入2molA和4molB,即乙容器内的气体的物质的量为甲容器内的气体的物质的量的2倍,而乙容器的体积为甲容器的体积的2倍,在相同温度下达到相同平衡状态,平衡时同种物质的浓度相等,
A.保持温度和活塞位置不变,在甲中再加入1molA和2molB,则相当于在原来的基础上增大压强,平衡向逆反应方向移动,达到平衡时,甲中C的浓度小于原来的2倍,即甲中C的浓度小于乙中C的浓度的2倍,故A错误;
B.保持温度不变,移动活塞P,使乙的容积和甲相等,相当于增大乙的压强,平衡向逆反应方向移动,减小加的压强平衡向正反应方向移动,达到新的平衡后,乙中C的体积分数小于甲中C的体积分数的2倍,故B错误;
C.甲中温度和体积不变充入稀有气体,没有改变气体的浓度,对反应速率没有影响,可以用图2表示,乙中温度和压强不变,充入稀有气体,相当于增大容器体积,气体浓度减小,反应速率减小,生成物的浓度减小的程度大些,化学平衡正向移动,可以用图3表示,故C正确;
D.保持活塞位置不变,升高两个容器的温度,平衡向正反应方向移动,甲、乙中B的体积分数都减小,故D错误;
故选C.
点评 本题考查化学平衡及其综合应用,题目难度中等,注意从等效平衡的角度分析起始时甲乙两容器内的气体的平衡状态,关键是对等效平衡的理解,试题培养了学生的分析能力及灵活应用能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 加入水时,平衡向逆反应方向移动 | |
| B. | 加入少量0.1 mol/L HCl溶液,溶液中c(H+)不变 | |
| C. | 加入少量NaOH固体,平衡向正反应方向移动 | |
| D. | 加入少量CH3COONa固体,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
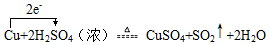 .实验测得,反应中生成了标准状况下的SO2气体44.8L,则耗氧化剂的物质的量为2mol.
.实验测得,反应中生成了标准状况下的SO2气体44.8L,则耗氧化剂的物质的量为2mol.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
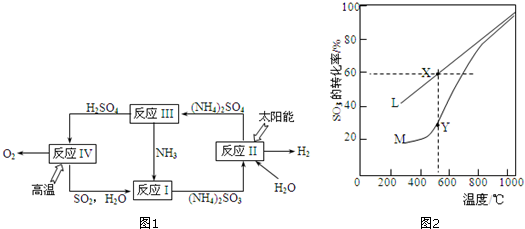
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
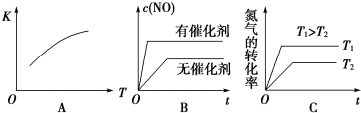
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+、Fe2+、Ba2+、NO3- | B. | Na+、K+、HCO3-、Cl- | ||
| C. | Ag+、Na+、NO3-、Cl- | D. | NH4+、Fe3+、SO42-、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com