
分析 若将Na2CO3溶液滴入盐酸溶液,则盐酸相对过量,所有CO32-都会转化为CO2,反应反应为CO32-+2H+=CO2↑+H2O;反之,将盐酸溶液滴入Na2CO3溶液,则盐酸相对不足,前一部分盐酸将CO32-先转化为HCO3-,反应为CO32-+H+=HCO3-,碳酸根离子完全反应后,剩余的一部分盐酸使HCO3-转化为CO2,其反应为HCO3-+H+=CO2↑+H2O,因为两次所得CO2 体积不同,说明15mLNa2CO3相对于25mL盐酸来说过剩,所以乙是碳酸钠,甲是盐酸,结合反应的离子方程式计算.
解答 解:(1)当向盐酸中加入Na2CO3溶液时,发生反应2H++CO32-=CO2↑+H2O,盐酸完全反应后,再加入的Na2CO3不再放出CO2;向Na2CO3溶液中加入盐酸时,先发生反应CO32-+H+=HCO3-,当所有CO32-均转化为HCO3-时,再发生反应HCO3-+H+=CO2↑+H2O,由实验①②中数据可知等量的甲与等量的乙反应,实验①产生的CO2气体多,说明甲为HCl、乙为Na2CO3,
故答案为:HCl;Na2CO3;
(2)②实验中所发生反应的离子方程式为CO32-+H+=HCO3-、HCO3-+H+=CO2↑+H2O,
故答案为:CO32-+H+=HCO3-、HCO3-+H+=CO2↑+H2O;
(3)量取20mL甲溶液,向其中缓慢滴加乙溶液25mL,共收集到二氧化碳112mL,n(CO2)=0.005mol,2HCl+Na2CO3=2NaCl+H2O+CO2↑,HCl完全反应,Na2CO3剩余,n(HCl)=2n(CO2)=2×0.005mol=0.01 mol,c(HCl)=$\frac{0.01mol}{0.02L}$=0.5mol/L,
取25mL乙溶液,向其中缓慢滴入甲溶液20mL,共收集到56mL(标准状况)气体,HCl与Na2CO3均完全反应,Na2CO3先生成NaHCO3,部分NaHCO3 转化为CO2:n(CO2)=0.0025mol;HCl+Na2CO3=NaHCO3+NaCl,HCl+NaHCO3=NaCl+H2O+CO2↑,在②中,产气0.0025mol,说明第二反应盐酸用去0.0025mol,参与第一反应的就是0.0075mol,那么碳酸钠的量就是0.0075mol,c(Na2CO3)=$\frac{0.0075mol}{0.025L}$=0.3mol/L,
答:甲溶液的物质的量浓度为0.5mol/L;乙溶液的物质的量浓度为0.3mol/L.
点评 本题考查了物质的检验和有关化学方程式的计算,明确碳酸钠与盐酸反应的分步进行是解题关键,注意滴加顺序不同的本质是反应物量不同导致反应不同,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
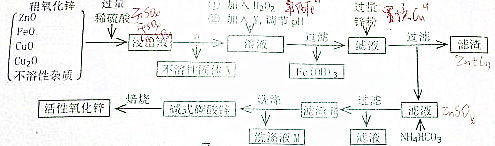
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 做过碘升华实验的烧杯用酒精洗涤 | |
| B. | 做过银镜反应实验的试管用稀硝酸洗涤 | |
| C. | 将汽油放在带橡皮塞的玻璃瓶中 | |
| D. | 往双氧水中滴入几滴三氯化铁溶液加快分解速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 实验目的 | 主要玻璃仪器 | 试剂 |
| A | 分离乙醇和乙酸混合物 | 蒸馏烧瓶、冷凝管、酒精灯、温度计、锥形瓶 | 乙醇和乙酸混合物 |
| B | 鉴别NH4Cl中的阳离子 | 试管、酒精灯 | NH4Cl、红色石蕊试纸、蒸馏水 |
| C | 实验室制取CO2 | 试管、带导管的橡皮塞 | 大理石、稀H2SO4 |
| D | 测定FeSO4溶液浓度 | 滴定管、锥形瓶、烧杯 | FeSO4溶液、0.1000mol•L-1KMnO4 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Fe2+、NO3-、H+ | B. | K+、Cu2+、NO3-、H+ | ||
| C. | H+、Na+、NO3-、HCO3- | D. | NH4+、Fe2+、NO3-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
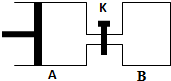 如图所示,容器A左侧是可平行移动的活塞.向A中充入1molX和1molY,向B中充入2molX和2molY,起始时V(A)=V(B)=aL.在相同温度和有催化剂存在的条件下,两容器各自发生:X(g)+Y(g)?Z(g)+2W(g),达到平衡时V(A)=1.2aL.试回答:
如图所示,容器A左侧是可平行移动的活塞.向A中充入1molX和1molY,向B中充入2molX和2molY,起始时V(A)=V(B)=aL.在相同温度和有催化剂存在的条件下,两容器各自发生:X(g)+Y(g)?Z(g)+2W(g),达到平衡时V(A)=1.2aL.试回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com