
| A. | 是烃类化合物 | B. | 常温下呈固态 | ||
| C. | 具有类似金刚石的硬度 | D. | 分子中最多可能有281个碳碳叁键 |
分析 A.烃是指只含有C、H两种元素的化合物;
B.相对分子质量很大,分子间作用力大,熔点沸点比较大;
C.根据两者的构成进行分析;
D.根据$\frac{2N(C)+2-N(H)}{2}$计算不饱和度,据此判断.
解答 解:A.该物质只含有C、H两种元素,属于烃类化合物,故A正确;
B.相对分子质量很大,分子间作用力大,熔点沸点比较大,常温下是固态,故B正确;
C.金刚石是原子构成的网状结构,属于原子晶体,而该物质是分子构成的,属于分子晶体不具有类似金刚石的硬度,故C错误;
D.该物质的不饱和度为$\frac{1134×2+2-1146}{2}$=562,又1个碳碳叁键含2个不饱和度,所以分子中中最多可能有281个碳碳叁键,故D正确;
故选C.
点评 本题考查有机物的组成、结构与性质等,比较基础,难度不大,旨在考查学生对知识的简单利用,注意基础知识的掌握.


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2和CO2均是酸酐 | |
| B. | SO2能使品红溶液褪色而CO2则不能 | |
| C. | SO2和CO2均能跟石灰水反应生成白色沉淀 | |
| D. | SO2和CO2均既有氧化性又有还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应的焓变为正值 | |
| B. | 加入催化剂,可以增加单位体积内的活化百分子数 | |
| C. | 体积不变,冲入氦气,压强增大,化学反应速率增大 | |
| D. | 降低温度,K变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
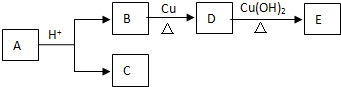
| A. | 符合上述转化关系的有机物A的结构有8种 | |
| B. | C和E一定为同系物 | |
| C. | 1molB完全转化为D转移2mol电子 | |
| D. | D到E发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
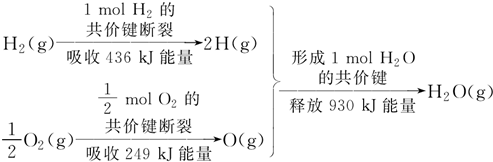
| A. | 1 mol H2的共价键形成放出436 kJ能量 | |
| B. | 氢气跟氧气反应生成水的同时吸收能量 | |
| C. | 1 mol H2(g)跟$\frac{1}{2}$ mol O2(g)反应生成1 mol H2O(g)释放能量245 kJ | |
| D. | 1 mol H2(g)与$\frac{1}{2}$ mol O2(g)的总能量大于1 mol H2O(g)的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正丁烷和异丁烷的熔点、沸点各不相同 | |
| B. | 乙醛和丙烯醛( )与H2充分反应后的产物是同系物 )与H2充分反应后的产物是同系物 | |
| C. | 某有机物燃烧生成等物质的量的CO2和H2O,该有机物的通式一定为CnH2n | |
| D. | 用质谱法测定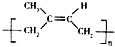 的平均相对分子质量,可得其聚合度 的平均相对分子质量,可得其聚合度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com