
(14分) CuCl是有机合成的重要催化剂,并用于颜料、防腐等工业。工业上由废铜料(含Fe、Al及其化合物、SiO2杂质),生产CuCl的工艺流程如下:

物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Cu(OH)2 | 5.6 | 6.7 |
Al(OH)3 | 3.8 | 4.7 |
已知:CuCl溶于NaCl的浓溶液可生成CuCl2-,CuCl2-的溶液用水稀释后可生成CuCl沉淀。
(1)煅烧的主要目的是: 。
(2)操作Ⅰ为调节溶液的PH值,范围为 ,加入的物质X可以是( )
A、CuO B、Cu(OH)2 C、NaOH 溶液 D、CaCO3
(3)滤渣Ⅱ的主要成分是 。
(4)往滤液Ⅱ中加入食盐并通入SO2可生成CuCl2-,请写出反应的离子方程式: 。
(5)在反应Ⅰ中,温度控制在70~80℃并使用浓NaCl溶液,主要目的是: 。
(6)常温下,已知CuOH的KSP为1.0×10-14,则Cu++H2O  CuOH + H+的平衡常数为: 。
CuOH + H+的平衡常数为: 。
(1)使铜转化为可溶于酸的氧化物 (2)4.7≤PH<5.6 ABC(3)Fe(OH)3 和 Al(OH)3
(4)2H2O+2Cu2++SO2+4Cl-=2 CuCl2-+ SO42-+4H+ (5)提高的CuCl2—生成速率 (6)1
【解析】
试题分析:(1)煅烧的主要目的是使铜转化为可溶于酸的氧化物。(2)操作Ⅰ为调节溶液的PH值,要想溶液中加入的物质消耗H+,同时不引入新的杂质离子,对后边的形成CuCl沉淀有利的物质,应该是CuO、Cu(OH)2、NaOH 溶液。因此选项为A、B、C。调整溶液的pH的范围应该是使杂质离子形成沉淀除去而Cu2+留在溶液中,根据表格提供的数据,应该在4.7~5.6。(3)此时产生的滤渣Ⅱ的主要成分是Fe(OH)3 和 Al(OH)3;(4)往滤液Ⅱ中加入食盐并通入SO2发生氧化反应反应,可生成CuCl2-,该反应的离子方程式是2H2O+2Cu2++SO2+4Cl-=2 CuCl2-+ SO42-+4H+;(5)在反应Ⅰ中,温度控制在70~80℃并使用浓NaCl溶液,主要目的是提高的CuCl2—生成速率;(6)因为在常温下,已知CuOH的KSP为1.0×10-14,所以c(Cu+)=1.0×10-14÷10-7=10-7mol/L;Cu++H2O  CuOH + H+的平衡常数为
CuOH + H+的平衡常数为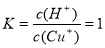 .
.
考点:考查生产CuCl的反应原理、操作方法、实验条件的选择、离子方程式的书写、沉淀溶解平衡的应用。


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源:2013-2014山西省高一下学期期中化学试卷(解析版) 题型:填空题
(6分)下表是元素周期表的一部分,请回答有关问题:
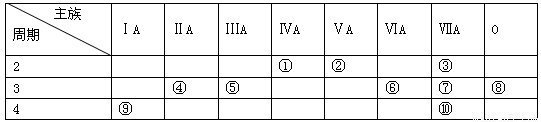
(1)表中化学性质最不活泼的元素,其原子结构示意图为 。
(2)表中能形成两性氢氧化物的元素是 (用元素符号表示),写出该元素的单质与⑨最高价氧化物的水化物反应的化学方程式 。
(3)①、⑥、⑦四种元素的最高价氧化物的水化物中酸性最强的是 (填化学式)。
(4)③元素与⑩元素两者核电荷数之差是 。
查看答案和解析>>
科目:高中化学 来源:2013-2014山西省6月高二化学期末测试卷(解析版) 题型:选择题
某常见有机物(一个分子内碳原子总数不超过10个)的结构简式可表示为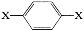 其1H核磁共振谱图中出现两组峰,且不同化学环境的氢原子数之比为3:2。下列关于该有机物的说法错误的是
其1H核磁共振谱图中出现两组峰,且不同化学环境的氢原子数之比为3:2。下列关于该有机物的说法错误的是
A.该有机物不可能为芳香醇
B.该有机物的分子式可能为C8H10O2
C.该有机物可能与NaOH溶液反应
D.该有机物燃烧时一定只生成CO2和H2O
查看答案和解析>>
科目:高中化学 来源:2013-2014山西忻州一中、长治二中、临汾一中、康杰中学高三化学(解析版) 题型:填空题
(15分)白酒产品中的塑化剂主要源于塑料接酒桶、塑料输酒管、成品酒塑料内盖等。DBP是塑化剂的一种,可由下列路线合成:

已知以下信息:
①
②
(-R1、-R2表示氢原子或烃基)
(1)A的结构简式 ,D的结构简式是 ,D→E的反应类型 。
(2)D和H2 1︰1反应生成E,则E官能团名称为_________,DBP的分子式为 .
(3)由B和E以物质的量比1︰2合成DBP的化学方程式: 。
(4)写出同时符合下列条件的B的所有同分异构体结构简式 。
①能和NaHCO3溶液反应生成CO2 ③能使FeC13溶液发生显色反应
②能发生银镜反应 ④苯环上含碳基团处于对位
(5)写出B与碳酸氢钠溶液反应的方程式 。
写出C生成D的反应的方程式 。
查看答案和解析>>
科目:高中化学 来源:2013-2014山西忻州一中、长治二中、临汾一中、康杰中学高三化学(解析版) 题型:选择题
分析下表中各项的排布规律,有机物X是按此规律排布的第23项,下列有关X的组成、性质的说法中肯定错误的是
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
CH4 | CH2O | CH2O2 | CH4O | C2H6 | C2H4O | C2H4O2 | C2H6O |
①是己酸②是己醇 ③是戊酸甲酯 ④在稀硫酸中易变质⑤一定能与钠反应
A.②⑤ B.①③④ C.③④ D.②③⑤
查看答案和解析>>
科目:高中化学 来源:2013-2014山西大学附中高三第二学期5月理科综合化学试卷(解析版) 题型:填空题
(14分)为回收利用废钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,主要流程如下:

部分含钒物质在水中的溶解性如下:
物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
回答下列问题:
⑴工业由V2O5冶炼金属钒常用铝热剂法,写出该反应的化学方程式 。
⑵图中所示滤液中含钒的主要成分为 (写化学式)。
⑶该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,该步反应的离子方程式 ;沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度。根据下图判断最佳控制氯化铵系数和温度为 、 。

⑷用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应②后溶液中含钒量,完成反应的离子方程式为□VO2++□H2C2O4+□_____ =□VO2++□CO2↑+□H2O。
⑸全矾液流电池的电解质溶液为VOSO4溶液,电池的工作原理为VO2++V2++2H+ 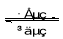 VO2++H2O+V3+,电池充电时阳极的电极反应式为 。
VO2++H2O+V3+,电池充电时阳极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省青岛市高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
25℃时,已知弱酸的电离常数:K(CH3COOH) = 1.8 ×10-5;K1(H2CO3) = 4.4 ×10-7;K2(H2CO3) = 4.7 × 10-11;K(HClO) = 4.0 ×10-8。则下列说法正确的是
A.新制氯水与碳酸氢钠不反应
B.25℃时,0.1mol/L的醋酸溶液与0.01mol/L的醋酸溶液中,Ka前者小于后者
C.NaClO溶液中通入少量二氧化碳的反应为:2NaClO+CO2+ H2O = Na2CO3 +2HClO
D.等物质的量浓度的碳酸钠溶液、醋酸钠溶液、次氯酸钠溶液的pH
pH(Na2CO3)>pH(NaClO)>pH(CH3COONa)
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省潍坊市下学期期中考试高二化学试卷(解析版) 题型:选择题
同温同压下,某有机物和过量Na反应得到V1 L氢气,取另一份等量的有机物和足量NaHCO3反应得V2 L二氧化碳,若V1=V2 ≠ 0,则该有机物可能是
A.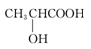 B.HOOC—COOH
B.HOOC—COOH
C.HOCH2CH2OH D.CH3COOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com