
| A. | 室温下,1L pH=13的氢氧化钡溶液所含OH- 数为0.2NA | |
| B. | 标准状况下,0.1molAl3+含有的核外电子数为0.3 NA | |
| C. | 常温下,44gCO2中含有2NA个碳氧双键 | |
| D. | 将1 molN2 和3mol H2 通入密闭容器中,一定条件下充分反应,转移电子数为6NA |
分析 A、pH=13的氢氧化钡溶液中,氢氧根的浓度为0.1mol/L;
B、铝离子的核外有10个电子;
C、求出二氧化碳的物质的量,然后根据二氧化碳中含2条碳氧双键来分析;
D、合成氨的反应为可逆反应.
解答 解:A、pH=13的氢氧化钡溶液中,氢氧根的浓度为0.1mol/L,故1L溶液中含有的氢氧根的物质的量为0.1mol,个数为0.1NA个,故A错误;
B、铝离子的核外有10个电子,故0.1mol铝离子的核外有1mol即NA个电子,故B错误;
C、44g二氧化碳的物质的量为1mol,而二氧化碳中含2条碳氧双键,故1mol二氧化碳中含2mol碳氧双键即2NA条,故C正确;
D、合成氨的反应为可逆反应,故不能进行完全,故转移的电子数小于6NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | a=b=c | B. | b>a>c | C. | b>c>a | D. | b=c>a |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
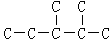 ,此烷烃的一溴代物有6种;若此烷烃由炔烃加氢制得,则此炔烃的结构简式为(CH3)2CH(CH3)CHC≡CH
,此烷烃的一溴代物有6种;若此烷烃由炔烃加氢制得,则此炔烃的结构简式为(CH3)2CH(CH3)CHC≡CH查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | CO2 | CO | |||
| A | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| B | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| C | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2是由极性键构成的非极性分子 | |
| B. | 若NA表示阿伏伽德罗常数,常温常压下60g SiO2中含有的共价键数目为2NA | |
| C. | 碳和硅同主族,因此CO2和SiO2化学性质相似,物理性质也相似 | |
| D. | SiO2晶体结构中的最小环为6个Si和6个O组成的12元环 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
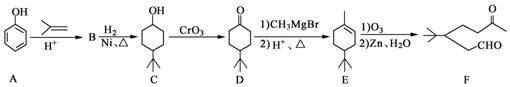
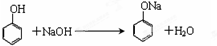 .
. ,A到B的反应类型为加成反应.
,A到B的反应类型为加成反应. (任写一种).
(任写一种).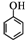 )和CH2=CH2为原料制备有机物 的
)和CH2=CH2为原料制备有机物 的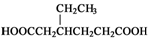 合成路线流程图(无机试剂任用).
合成路线流程图(无机试剂任用).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com