
| A. | 单位时间里生成 n mol A2,同时消耗 2n mol AB | |
| B. | 容器中的总压强不随时间而变化 | |
| C. | A2、B2、AB的物质的量之比满足1:1:2 | |
| D. | 单位时间里生成2n mol AB的同时生成n mol B2 |
分析 化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断,得出正确结论.
解答 解:A.单位时间生成nmol的A2为逆反应,同时生成nmol的AB是正反应,但化学反应速率之比与化学计量数之比不等,故正逆反应速率不等,故A错误;
B.反应前后气体的体积不等,故容器总压强不随时间改变不可作为判断是否达到化学平衡状态的依据,故B错误;
C.平衡时各物质多少决定于开始加入的多少和反应程度,与平衡状态无关,其不能作为判断是否达到化学平衡状态的依据,故C错误;
D.单位时间生成2nmol的AB为正反应,同时生成nmol的B2是逆反应,其速率之比等于化学计量数之比,说明正逆反应速率相等,反应达到平衡状态,故D正确;
故选D.
点评 本题考查化学平衡状态的判断,题目难度不大.要注意把握平衡状态的特征.


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:选择题
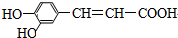
| A. | 只有②④⑤⑥ | B. | 只有①③④⑥ | C. | 只有①②③⑤ | D. | ①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
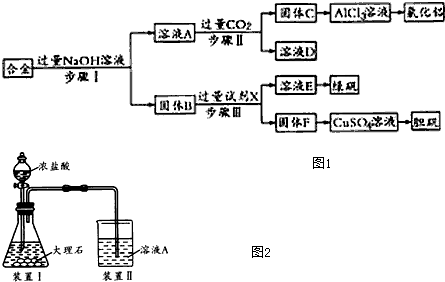
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(B)=0.075mol/(L•s) | B. | v(A)=0.030mol/(L•s) | C. | v(C)=0.040mol/(L•s) | D. | v(D)=0.060mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度 | B. | 使用催化剂 | ||
| C. | 充入稀有气体,增大体系压强 | D. | 增加N2和H2的起始量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ) 4种有机物分别在一定条件下与H2充分反应.
) 4种有机物分别在一定条件下与H2充分反应. 滴入溴水后,反应生成产物的结构简式为
滴入溴水后,反应生成产物的结构简式为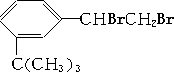 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O (l)+CaO(s)═Ca(OH)2(s) | |
| B. | Ba(OH)2•8H2O+2NH4Cl═BaCl2+2NH3•H2O+8H2O | |
| C. | 2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑ | |
| D. | CH4(g)+2O2(g)$\frac{\underline{\;点燃\;}}{\;}$CO2(g)+2H2O(l) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com