
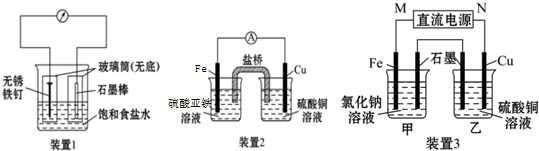
分析 (1)铁发生吸氧腐蚀,铁被氧化生成Fe2+,Fe2+与K3[Fe(CN)6]反应生成蓝色沉淀,正极发生还原反应,氧气得到电子被还原生成OH-;
(2)形成原电池,Fe失电子作负极,铜离子在正极得电子;
(3)向甲烧杯中滴入几滴酚酞,观察到Fe电极附近首先变红,说明Fe极生成4OH-,应为电解池的阴极,则M为负极,N为正极,乙烧杯中Cu为阳极,Cu失电子生成铜离子,石墨为阴极,阴极上铜离子得电子生成Cu.
解答 解:(1)铁发生吸氧腐蚀,铁被氧化生成Fe2+,正极发生还原反应,氧气得到电子被还原生成OH-,电极方程式为O2+4e-+2H2O-═4OH-,
故答案为:氧化;O2+4e-+2H2O-═4OH-;
(2)形成原电池,Fe失电子作负极,铜离子在正极得电子,发生Fe+Cu2+=Cu+Fe2+,
故答案为:负;Fe+Cu2+=Cu+Fe2+;
(3)向甲烧杯中滴入几滴酚酞,观察到Fe电极附近首先变红,说明Fe极生成4OH-,应为电解池的阴极,则M为负极,N为正极,甲烧杯中石墨电极为阳极,其电极反应式为2Cl--2e-═Cl2↑;乙烧杯中Cu为阳极,Cu失电子生成铜离子,石墨为阴极,阴极上铜离子得电子生成Cu,所以溶液中硫酸铜的浓度不变,则溶液的pH不;
故答案为:负;2Cl--2e-═Cl2↑;不变.
点评 本题考查电化学知识,题目难度中等,做题时注意电极的判断和电极反应的书写,注意串联电路中各电极转移的电子数目相等,侧重于考查学生的分析能力.


 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 23gNO2和23gN2O4所含原子数目均为1.5NA | |
| B. | 5.6 g铁与足量盐酸反应转移的电子数为0.3NA | |
| C. | 在常温常压下11.2L氯气所含的原子数目为NA | |
| D. | 高温下,0.2molFe与足量水蒸气反应,生成的H2分子数目为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 弱电解质在溶液中部分电离,存在电离平衡 | |
| B. | 同一弱电解质的溶液,当温度或浓度不同时,其导电能力也不相同 | |
| C. | 电离常数(K)越小,表示弱电解质电离能力越弱 | |
| D. | 不同浓度的同一弱电解质,其电离常数(K)不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化碳:K+、Na+、SiO32-、Cl- | B. | 氨气:Ag+、Al3+、Na+、NO3- | ||
| C. | 氯化氢:Ca2+、Fe3+、NO3-、Cl- | D. | 氯气:Na+、Ba2+、I-、HSO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
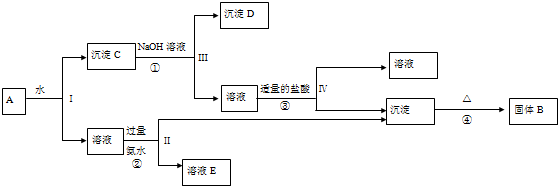
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
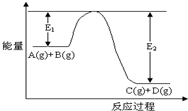 反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题
反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法 | |
| B. | 在镀件上电镀锌,用锌作阳极 | |
| C. | 用如图1装置生产家用消毒液(NaClO) | |
| D. | 用如图2装置为铅蓄电池充 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com