
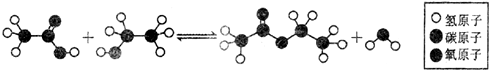
| A. | 取代反应 | B. | 加成反应 | C. | 水解反应 | D. | 加聚反应 |
 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:填空题
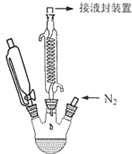 二茂铁的化学式为(C5H5)2Fe,它是一种橙黄色针状晶体,熔点173--174℃,100℃以上显著升华,沸点249℃,不溶于水,可溶于甲醇、乙醇、乙醚和苯等有机溶剂,可作高性能的火箭燃料添加剂.实验室制备二茂铁的反应原理为:8KOH+2C5H6+FeCl2•4H2O$\frac{\underline{\;\;△\;\;}}{\;}$(C5H5)2Fe+2KCl+6KOH•H2O实验装置如图所示(加热及磁力搅拌装置未画出).
二茂铁的化学式为(C5H5)2Fe,它是一种橙黄色针状晶体,熔点173--174℃,100℃以上显著升华,沸点249℃,不溶于水,可溶于甲醇、乙醇、乙醚和苯等有机溶剂,可作高性能的火箭燃料添加剂.实验室制备二茂铁的反应原理为:8KOH+2C5H6+FeCl2•4H2O$\frac{\underline{\;\;△\;\;}}{\;}$(C5H5)2Fe+2KCl+6KOH•H2O实验装置如图所示(加热及磁力搅拌装置未画出).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
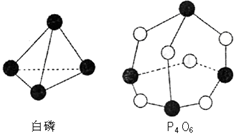 化学反应可视为旧健断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)出的能量.已知白磷和P4O6的分子结构如右图所示,现提供以下化学键的键能(kJ•mol-1)P-P:198;P-O:360;O-O:498.则反应P4(白磷)+3O2=P4O6的反应热△H为( )
化学反应可视为旧健断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)出的能量.已知白磷和P4O6的分子结构如右图所示,现提供以下化学键的键能(kJ•mol-1)P-P:198;P-O:360;O-O:498.则反应P4(白磷)+3O2=P4O6的反应热△H为( )| A. | -1638kJ/mol | B. | +1638kJ/mol | C. | -126kJ/mol | D. | +126kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②④⑤ | C. | ③④⑤ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
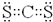 ,ci2与ce2比较,沸点较高的是CS2(写分子式).
,ci2与ce2比较,沸点较高的是CS2(写分子式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
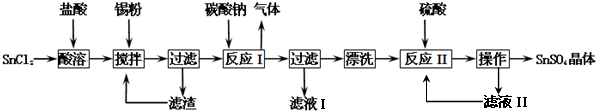
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流 程示意图如下:
由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流 程示意图如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com