
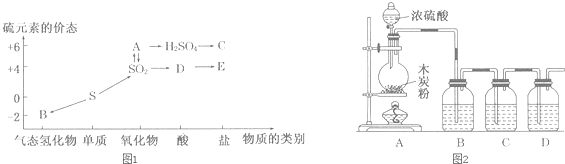
分析 (1)①硫元素的化合价有-2、0、+4、+6价,A中的S的化合价为+6价,A为三氧化硫;B为硫化氢;
②二氧化硫与氧气反应生成三氧化硫;
(2)①②③木炭与浓硫酸在加热条件下反应生成二氧化碳、二氧化硫和水;二氧化硫具有漂白性能够使品红溶液褪色,通常用品红溶液检验二氧化硫的存在,二氧化碳、二氧化硫都是酸性氧化物,都能使澄清石灰水先变浑浊再变澄清,所以检验二氧化碳的存在应排除二氧化硫,二氧化硫具有还原性能够被酸性高锰酸钾氧化,可以用高锰酸钾检验二氧化硫存在,也可以用酸性的高锰酸钾除去二氧化硫,据此解答;
④①使澄清石灰水变浑浊的气体有二氧化碳、二氧化硫等;
②使湿润的蓝色石蕊试纸变红说明是酸性气体;
③品红溶液褪色加热恢复红色是二氧化硫的漂白性;
④二氧化碳、二氧化硫通入足量NaOH溶液中,再滴加BaCl2溶液,有白色沉淀生成,该沉淀溶于稀盐酸;
⑤通入溴水中,能使溴水褪色,说明气体具有还原性,被氧化,再滴加Ba(NO3)2溶液有白色沉淀产生,证明是二氧化硫.
解答 解:(1)①A中的S的化合价为+6价且可以转化为硫酸,又可以和二氧化硫互相转化,因此A为三氧化硫;B中的硫的化合价为-2价,且为气态氢化物,因此B为硫化氢,
故答案为:SO3;H2S;
②二氧化硫与氧气反应生成三氧化硫:方程式:2SO2+O2$?_{△}^{催化剂}$2SO3;
故答案为:2SO2+O2$?_{△}^{催化剂}$2SO3;
(2)①木炭与浓硫酸在加热条件下反应生成二氧化碳、二氧化硫和水,方程式:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
②木炭与浓硫酸在加热条件下反应生成二氧化碳、二氧化硫和水,二氧化碳、二氧化硫都是酸性氧化物,都能使澄清石灰水先变浑浊再变澄清,所以要检验二氧化碳,应排除二氧化硫的干扰,用酸性的高锰酸钾检验、吸收二氧化硫,用品红溶液检验二氧化硫是否除尽,最后用澄清石灰水检验二氧化碳存在;
故答案为:检验二氧化硫是否除尽;
③二氧化硫为酸性氧化物,也能和氢氧化钙反应的化学方程式为:Ca(OH)2+SO2═CaSO3↓+H2O;
故答案为:Ca(OH)2+SO2═CaSO3↓+H2O;
④a.二氧化碳、二氧化硫都是酸性氧化物,和碱反应生成盐和水,都可以使澄清石灰水变浑浊,故a错误;
b.二氧化碳、二氧化硫、三氧化硫等酸性氧化物气体,遇到水生成对应的酸,溶液酸性都可以使湿润的蓝色石蕊试纸变红色,故b错误;
c.使品红溶液褪色的气体可以是氯气、二氧化硫等氧化性气体,不一定是二氧化硫,若证明是二氧化硫需要对褪色溶液加热若恢复红色说明是二氧化硫,故c错误;
d.二氧化碳、二氧化硫通入氢氧化钠溶液中生成提示盐、亚硫酸盐,加入氯化钡溶液反应会生成碳酸钡、亚硫酸钡白色沉淀,故d错误;
e.通入溴水中,能使溴水褪色,说明气体具有还原性,被氧化,再滴加Ba(NO3)2溶液有白色沉淀产生,证明是二氧化硫;故e正确;
故选:e.
点评 本题考查了浓硫酸性质应用,理解浓硫酸的性质中的和碳单质的反应,熟悉二氧化硫的性质是解题关键,题目难度中等.


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 加入BaCl2溶液产生不溶于稀HNO3的白色沉淀,说明原溶液中有SO42- | |
| B. | 加入盐酸,生成的气体能使澄清石灰水变浑浊,可确定有CO32-存在 | |
| C. | 验证烧碱溶液中是否含有Cl-,先加稀硝酸除去OH-,再加入AgNO3溶液,有白色沉淀,证明含Cl- | |
| D. | 加入NaOH溶液有白色沉淀出现,则原溶液中一定含有Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 多余的氯气可以用氢氧化钠溶液吸收 | |
| B. | 用澄清的石灰石可以鉴别CO2和SO2 | |
| C. | SO2、Cl2都能使品红溶液褪色,其原理不同 | |
| D. | 铁丝在氯气中燃烧生成三价铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com