
 .
. .
.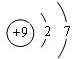 .
.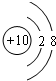 .
. 分析 (1)A元素原子核外M层电子数是L层电子数的一半,M层电子数为4,则A为Si;
(2)B元素原子的最外层电子数是次外层电子数的1.5倍,原子只能有2个电子层,最外层电子数为3,故B为硼元素;
(3)C元素的单质在常温下可与水剧烈反应,产生的气体能使带火星的木条复燃,则C为氟元素;
(4)D元素的原子的次外层电子数是最外层电子数的0.25倍,则次外层为K层,L层电子数为8,故D为Ne.
解答 解:(1)A元素原子核外M层电子数是L层电子数的一半,M层电子数为4,则A为Si,原子结构示意图为: ,故答案为:硅、
,故答案为:硅、 ;
;
(2)B元素原子的最外层电子数是次外层电子数的1.5倍,原子只能有2个电子层,最外层电子数为3,故B为硼元素,原子结构示意图为: ,
,
故答案为:硼、 ;
;
(3)C元素的单质在常温下可与水剧烈反应,产生的气体能使带火星的木条复燃,则C为氟元素,原子结构示意图为: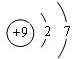 ,
,
故答案为:氟、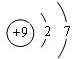 ;
;
(4)D元素的原子的次外层电子数是最外层电子数的0.25倍,则次外层为K层,L层电子数为8,故D为Ne,原子结构示意图为: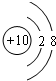 ,
,
故答案为:氖、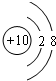 .
.
点评 本题考查原子结构与元素周期率,侧重考查核外电子排布,比较基础,推断元素是关键,注意理解掌握原子结构示意图的书写.


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 向盐酸中加入几滴碳酸钠溶液:H++CO32-═HCO3- | |
| B. | 向三氯化铁溶液中加入碘化钾溶液:Fe3++2I-═Fe2++I2 | |
| C. | 过量的铁粉加入稀硝酸中:Fe+4H++NO3-═Fe3++NO↑+2H2O | |
| D. | 等物质的量浓度的明矾溶液与氢氧化钡溶液按体积比1:2混合:Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能使pH试纸呈红色的溶液:Na+、NH4+、Fe2+、NO3- | |
| B. | 加入铝粉生成H2的溶液:K+、Mg2+、SO42-、HCO3- | |
| C. | c(Fe3+)=0.1 mol•L-1的溶液:H+、Al3+、Cl-、SCN- | |
| D. | 使酚酞变红色的溶液:Na+、Ba2+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,0.2 mol SO2与足量O2充分反应,生成SO3分子数为0.2NA | |
| B. | 0.1 mol NH2-中含有的电子数为0.9NA | |
| C. | 3.4 g H2O2中含有的共用电子对数为0.1NA | |
| D. | 常温常压下,16 g O2和O3混合气体含有的氧原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca2+、K+、Cl-、NO3- | B. | NH4+、Fe3+、I-、SO42- | ||
| C. | Na+、K+、ClO-、S2- | D. | Na+、S2O32-、AlO2-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 达到平衡时,两容器中反应物的转化率相同 | |
| B. | 平衡时甲容器中NH3(g)的体积分数比乙容器中的小 | |
| C. | Q1=0.2Q | |
| D. | 平衡时甲容器中气体的压强为开始时压强的3$\frac{3}{5}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al能溶于氯化铵溶液中且放出氢气 | |
| B. | Mg条在空气中燃烧可生成三种产物 | |
| C. | MgO是离子化合物,所以工业上用电解其熔融态的方法制取Mg | |
| D. | 向Al2(SO4)3溶液中滴加过量氨水,可得白色沉淀,加入过量NaHSO4溶液沉淀消失 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从100mL1.0mol•L-1的NaOH溶液中取出10mL该溶液,其溶液浓度仍为1.0mol•L-1 | |
| B. | 分离酒精和水可以采用分液的方法 | |
| C. | 在蒸发NaCl溶液时,等蒸发至少量液体时,停止加热,利用余热继续蒸干 | |
| D. | 在盛有碘水的试管中加入少量的CCl4后,充分振荡后下层颜色变为紫色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com