
【题目】分子式为C8H18的烷烃中,含有4个甲基的同分异构体的数目是( )
A.5种
B.6种
C.7种
D.8种
科目:高中化学 来源: 题型:
【题目】有机合成工业中原子利用率高、原料来源丰富、价格低廉且无污染,称其为“绿色化学”.以下反应中符合绿色化学原理的是( )
A.乙烯与氧气在银催化下生成环氧乙烷 ![]()
B.乙烷与氯气制备一氯乙烷
C.60℃时,乙炔与水在硫酸汞酸性溶液中合成乙醛
D.乙醇与浓硫酸共热制备乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C1化学是目前研究的热点问题。
(1)己知:2C(s)+O2(g)=2CO(g) △H =a kJ·mol-1 C(s)+H2O(g)=CO(g)+H2(g) △H =+130kJ·mol-1 H-H、O=O、H-O键的键能分别为436kJ/mol、496kJ/mol、462kJ/mol。则a=_______。
(2)以甲醇为原料制备H2的一种原理如下:
I.CH3OH(g) ![]() CO(g)+2H2(g) △H =+90kJ·mol-1
CO(g)+2H2(g) △H =+90kJ·mol-1
II.CO(g)+H2O(g)![]() CO2(g)+H2(g) △H =-41kJ·mol-1
CO2(g)+H2(g) △H =-41kJ·mol-1
①在绝热恒容密闭容器中,加入一定量的CH3OH(g)在一定条件下发生反应I,下列情况能说明该反应达到平衡状态的是____________(填代号)
A.容器内温度不变
B.容器内气体总质量不再变化
C.CH3OH(g)和CO(g)的浓度之比不再变化
D.混合气体的密度不再变化
②温度为T℃时,向10L恒容密闭容器中充入1molCH3OH(g)和lmolH2O(g),发生反应I和反应II,达到平衡时测得CO的物质的量为0.4mol,CO2的物质的量为0.2mol。则反应II的平衡常数K=_____。该温度下,在某时刻平衡体系中c(CO2)=2mol/L、c(H2)=2mol/L、c(CO)=4mol/L、c(H2O)=4mol/L,则该时刻上述反应II的平衡移动方向为__________(填“正反应方向”、“逆反应方向”或“不移动”)。
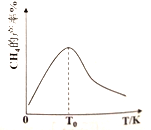
(3)H2和CO在一定条件(温度、压强和催化剂)下合成CH4,发生反应:CO(g)+3H2(g)![]() H4(g)+H2O(g)△H<0。如下图,温度低于T0时,随着温度升高,CH4的产率增大,其原因是_______________________________________________________________。
H4(g)+H2O(g)△H<0。如下图,温度低于T0时,随着温度升高,CH4的产率增大,其原因是_______________________________________________________________。
(4)合成气(H2、CO)不仅是化工原料,也是清洁能源。如果H2和CO以体积比1:1组成混合气体与空气构成碱性燃料电池(KOH溶液为电解质溶液且足量),假设CO和H2同时按比例发生反应,则燃料电池负极的电极反应式为____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在1L恒容密闭容器中X,Y,Z三种气体的物质的量随时间变化曲线如图所示,以下说法正确的是( ) 
A.反应开始至2min,反应的平均速率v(Z)=0.2mol/L
B.该反应的化学方程式为X+3Y═2Z
C.该反应平衡时,Y转化率为30%
D.3min时,充入X,v正增大,v逆减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在水溶液中发生如下反应:①16H++10C-+2XO![]() ===2X2++5C2+8H2O;②2A2++B2===2A3++2B-;③2B-+C2===B2+2C-。下列说法错误的是( )
===2X2++5C2+8H2O;②2A2++B2===2A3++2B-;③2B-+C2===B2+2C-。下列说法错误的是( )
A. 反应C2+2A2+===2A3++2C-可以进行
B. 反应③是置换反应
C. 氧化性由强到弱的顺序是XO![]() >C2>B2>A3+
>C2>B2>A3+
D. 还原性由强到弱的顺序是C->A2+>B->X2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通过2Al2O3+3C+6Cl2═4AlCl3+3CO2制取无水氯化铝,下列说法正确的是( )
A. AlCl3是氧化产物
B. Cl2是氧化剂
C. 每生成1 mol CO2,转移4个电子
D. C发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.碳酸氢钠的热稳定性比碳酸钠的强
B.等质量的碳酸钠、碳酸氢钠分别与足量的盐酸反应,前者产生的二氧化碳多
C.足量的碳酸钠和碳酸氢钠分别与等物质的量的盐酸反应,两者产生的二氧化碳一样多
D.等物质的量的碳酸钠和碳酸氢钠分别与足量盐酸反应,前者消耗的盐酸多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知充分燃烧ag乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量bkJ,则乙炔燃烧的热化学方程式正确的是( )
A.2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=﹣2bkJ/mol
B.C2H2(g)+ ![]() O2(g)═2CO2(g)+H2O(l)△H=2bkJ/mol
O2(g)═2CO2(g)+H2O(l)△H=2bkJ/mol
C.2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=﹣4bkJ/mol
D.2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=bkJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生33.6LH2;E的阳离子与A的阴离子核外电子层结构完全相同。

回答下列问题:
(1)A与E形成的化合物的化学式是 。
(2)B的最高价氧化物化学式为 ,C的元素名称为 ,
D的单质与水反应的方程式为_ 。
(3)向D与E形成的化合物的水溶液中滴入烧碱溶液直至过量,观察到的现象是 ,有关反应的离子方程式为 ; 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com