
ЁОЬтФПЁПввЛљЪхЖЁЛљУбЃЈвдETBEБэЪОЃЉЪЧвЛжжадФмгХСМЕФИпаСЭщжЕЦћгЭЕїКЭМСЁЃгУввДМгывьЖЁЯЉЃЈвдIBБэЪОЃЉдкДпЛЏМСHZSM-5ДпЛЏЯТКЯГЩETBEЃЌЗДгІЕФЛЏбЇЗНГЬЪНЮЊЃКC2H5OHЃЈgЃЉ+IBЃЈgЃЉETBEЃЈgЃЉЁїHЃЎЛиД№ЯТСаЮЪЬтЃК
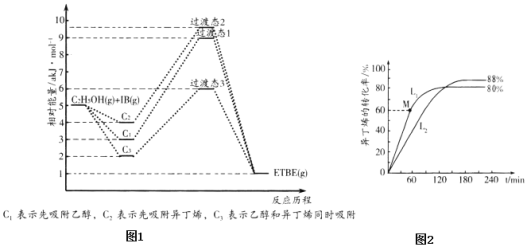
(1)ЗДгІЮяБЛДпЛЏМСHZSM-5ЮќИНЕФЫГађгыЗДгІРњГЬЕФЙиЯЕШчЭМ1ЫљЪОЃЌИУЗДгІЕФЁїH=______a kJmol-1ЃЎЗДгІРњГЬЕФзюгХЭООЖЪЧ______ЃЈЬюC1ЁЂC2ЛђC3ЃЉЁЃ
(2)дкИеадШнЦїжаАДЮяжЪЕФСПжЎБШ1ЃК1ГфШыввДМКЭвьЖЁЯЉЃЌдк378Kгы388KЪБвьЖЁЯЉЕФзЊЛЏТЪЫцЪБМфБфЛЏШчЭМ2ЫљЪОЁЃ
Ђй378KЪБвьЖЁЯЉЕФзЊЛЏТЪЫцЪБМфБфЛЏЕФЧњЯпЮЊ______ЃЈЬюL1ЛђL2ЃЉЁЃ
Ђк388KЪБЃЌвдЮяжЪЕФСПЗжЪ§БэЪОЕФЛЏбЇЦНКтГЃЪ§K=______ЁЃЃЈЮяжЪЕФСПЗжЪ§ЮЊФГзщЗжЕФЮяжЪЕФСПгызмЮяжЪЕФСПЕФБШЃЉ
ЂлвбжЊЗДгІЫйТЪv=vе§-vФц=kе§xЃЈC2H5OHЃЉxЃЈIBЃЉ-kФцxЃЈETBEЃЉЃЌЦфжаУые§ЮЊе§ЗДгІЫйТЪЃЌvФцЮЊФцЗДгІЫйТЪЃЌkе§ЁЂkФцЮЊЫйТЪГЃЪ§ЃЌxЮЊИїзщЗжЕФЮяжЪЕФСПЗжЪ§ЃЌМЦЫуMЕу![]() =______ЃЈБЃСєЕНаЁЪ§ЕуКѓ 1ЮЛЃЉЁЃ
=______ЃЈБЃСєЕНаЁЪ§ЕуКѓ 1ЮЛЃЉЁЃ
ЁОД№АИЁП-4 C3 L2 24 4.6
ЁОНтЮіЁП
ЃЈ1ЃЉИљОнЭМЯѓЃЌЗДгІЮяФмСПИпгкЩњГЩЮяФмСПЃЌдђЗДгІЮЊЗХШШЗДгІЃЌИљОнЕНДяЙ§ЖЩЬЌЕФЛюЛЏФмИпЕЭбЁдёКЯЪЪЕФЗДгІЭООЖЃЛ
ЃЈ2ЃЉЂйЮТЖШЩ§ИпЃЌЛЏбЇЗДгІЫйТЪдіДѓЃЌЗДгІЕНДяЦНКтЕФЪБМфЫѕЖЬЃЛ
Ђк388KЪБЃЌвьЖЁЯЉЕФЦНКтзЊЛЏТЪЮЊ80%ЃЌИљОнЗНГЬЪНМЦЫуЃЛ
ЂлИљОнЭМЯѓЃЌMЕувьЖЁЯЉЕФЦНКтзЊЛЏТЪЮЊ60%ЃЌИљОнЗНГЬЪНМЦЫуЁЃ
ЃЈ1ЃЉИљОнЭМЯѓЃЌЗДгІЮяФмСПИпгкЩњГЩЮяФмСПЃЌдђЗДгІЮЊЗХШШЗДгІЃЌдђИУЗДгІЕФЁїH=ЃЈ1-5ЃЉakJ/mol=-4akJ/molЃЌ
Й§ЖЩЬЌ1ЕФЛюЛЏФмЮЊE1=6akJ/molЃЌЙ§ЖЩЬЌ2ЕФЛюЛЏФмЮЊE2=6akJ/molЃЌЙ§ЖЩЬЌ3ЕФЛюЛЏФмЮЊE3=4akJ/molЃЌЫљвдЙ§ЖЩЬЌ3ЕФЛюЛЏФмзюЕЭЃЌЗДгІЯрЖдШнвзЃЌдђЗДгІРњГЬЕФзюгХЭООЖЪЧC3ЃЌ
ЙЪД№АИЮЊЃК-4ЃЛC3ЃЛ
ЃЈ2ЃЉЂйЮТЖШЩ§ИпЃЌЛЏбЇЗДгІЫйТЪдіДѓЃЌЗДгІЕНДяЦНКтЕФЪБМфЫѕЖЬЃЌдђ378KЪБвьЖЁЯЉЕФзЊЛЏТЪЫцЪБМфБфЛЏЕФЧњЯпЮЊL2ЃЌ
ЙЪД№АИЮЊЃКL2ЃЛ
ЂкЗЂЩњЕФЗДгІЮЊЃКC2H5OHЃЈgЃЉ+IBЃЈgЃЉETBEЃЈgЃЉЃЌвьЖЁЯЉЕФЦНКтзЊЛЏТЪЮЊ80%ЃЌ

ЫљвдЦНКтЪБxЃЈC2H5OHЃЉ=![]() =
=![]() ЃЌxЃЈIBЃЉ=
ЃЌxЃЈIBЃЉ=![]() ЃЌxЃЈETBEЃЉ=
ЃЌxЃЈETBEЃЉ=![]() ЃЌ
ЃЌ
дђK=![]() =
=![]() =24ЃЌ
=24ЃЌ
ЙЪД№АИЮЊЃК24ЃЛ
ЂлЗЂЩњЕФЗДгІЮЊЃКC2H5OHЃЈgЃЉ+IBЃЈgЃЉETBEЃЈgЃЉЃЌMЕуЪБвьЖЁЯЉЕФЦНКтзЊЛЏТЪЮЊ60%ЃЌ

MЕу![]() =24ЁС
=24ЁС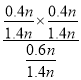 =4.6ЃЌ
=4.6ЃЌ
ЙЪД№АИЮЊЃК4.6ЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП2HI(g) ![]() H2(g)+I2(g)ЗДгІЙ§ГЬжаФмСПБфЛЏШчЭМЫљЪО(ЭМжаE1 БэЪОе§ЗДгІЕФЛюЛЏФмЃЌE2 БэЪОФцЗДгІЕФЛюЛЏФм)ЁЃ
H2(g)+I2(g)ЗДгІЙ§ГЬжаФмСПБфЛЏШчЭМЫљЪО(ЭМжаE1 БэЪОе§ЗДгІЕФЛюЛЏФмЃЌE2 БэЪОФцЗДгІЕФЛюЛЏФм)ЁЃ
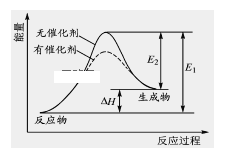
ЯТСагаЙиа№Ъіе§ШЗЕФЪЧЁЁ(ЁЁЁЁ)
A.Щ§ИпЮТЖШЃЌЗДгІЫйТЪдіДѓЃЌЁїHМѕаЁ
B.Щ§ИпЮТЖШЃЌВЛгАЯьЛюЛЏЗжзгАйЗжЪ§
C.ФцЗДгІЕФЛюЛЏФмЕШгке§ЗДгІЕФЛюЛЏФм
D.ДпЛЏМСФмНЕЕЭИУЗДгІЕФЛюЛЏФм
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПГЃЮТЯТЃЌЯђ![]()
![]() ШмвКжаМгШы
ШмвКжаМгШы![]() ОЇЬхЛђМгЫЎЯЁЪЭЪБЃЌЖМЛсв§Ц№
ОЇЬхЛђМгЫЎЯЁЪЭЪБЃЌЖМЛсв§Ц№
A.ШмвКжа діДѓB.ШмвКжа
діДѓB.ШмвКжа![]() діДѓ
діДѓ
C.ШмвКЕФЕМЕчФмСІМѕаЁD.![]() ЕФЕчРыГЬЖШдіДѓ
ЕФЕчРыГЬЖШдіДѓ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдк25mL0.1molLЁЊ1NaOHШмвКжаж№ЕЮМгШы0.1molL-1 CH3COOHШмвКЃЌЧњЯпШчЭМЫљЪОЃЌгаЙиСЃзгХЈЖШЙиЯЕе§ШЗЕФЪЧ( )
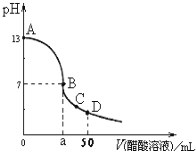
AЃЎдкAЁЂBМфШЮвЛЕуЃЌШмвКжавЛЖЈЖМгаc(Na+)+c(H+)=c(CH3COOЃ)+(OHЃ)
BЃЎдкBЕуЃЌaЃО25ЃЌЧвгаc(Na+)=c(CH3COOЃ)=c(OHЃ)=c(H+)
CЃЎдкCЕуЃКc(CH3COOЃ)ЃОc(Na+)ЃОc(OHЃ)ЃОc(H+)
DЃЎдкDЕуЃКc(CH3COOЃ)+c(CH3COOH)=c(Na+)
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПШЋЗАвКСїДЂФмЕчГиЪЧРћгУВЛЭЌМлЬЌЕФКЌЗАРызгдкЫсадЬѕМўЯТЗЂЩњЗДгІЃЌРызгЗНГЬЪНЮЊVO2+ЃЈЛЦЩЋЃЉ+V2+ЃЈзЯЩЋЃЉ+2H+![]() VO2+ЃЈРЖЩЋЃЉ+V3+ЃЈТЬЩЋЃЉ+H2OЃЎВЩгУЖшадЕчМЋЪЕЯжЛЏбЇФмКЭЕчФмЯрЛЅзЊЛЏЕФЙЄзїдРэШчЭМЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈЁЁЁЁЃЉ
VO2+ЃЈРЖЩЋЃЉ+V3+ЃЈТЬЩЋЃЉ+H2OЃЎВЩгУЖшадЕчМЋЪЕЯжЛЏбЇФмКЭЕчФмЯрЛЅзЊЛЏЕФЙЄзїдРэШчЭМЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈЁЁЁЁЃЉ

A.ГфЕчЙ§ГЬжаЃЌXЖЫНгЭтНгЕчдДЕФИКМЋ
B.ЗХЕчЙ§ГЬжаЃЌе§МЋЕчМЋЗДгІЪНЮЊVO2++H2O+e-=VO2++2OH-
C.ЗХЕчЙ§ГЬжаЃЌгвЙоШмвКбеЩЋж№НЅгЩТЬЩЋБфЮЊзЯЩЋ
D.ГфЕчЪБШєзЊвЦЕчзг0.5molЃЌзѓЙоШмвКжаnЃЈH+ЃЉЕФБфЛЏСПЮЊ0.5mol
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЩГРћЖШАЗЪЧвЛжжживЊЕФКЯГЩвЉЮяЃЌОпгаеђОВЁЂПЙбзжЂЕШзїгУЁЃгаЛњЮяHЪЧКЯГЩЫќЕФвЛжжжаМфЬхЃЌКЯГЩТЗЯпШчЭМЃЈВПЗжЗДгІЬѕМўКЭВњЮяЮДСаГіЃЉЁЃ

ЛиД№ЯТСаЮЪЬтЃК
(1)AЕФЛЏбЇУћГЦЮЊ______ЃЌEЁњFЕФЗДгІРраЭЮЊ______ЃЌHжаЙйФмЭХЕФУћГЦЮЊ______ЁЃ
(2)ХаЖЯЛЏКЯЮяFжага______ИіЪжадЬМдзгЁЃDЁњEЕФЗДгІЗНГЬЪНЮЊ______ЁЃ
(3)аДГіЗћКЯЯТСаЬѕМўЕФBЕФЭЌЗжвьЙЙЬх______ЃЈаДГівЛжжМДПЩЃЌВЛПМТЧСЂЬхвьЙЙЃЉ
ЂйФмгыFeC13ШмвКЗЂЩњЯдЩЋЗДгІ
Ђк1molИУЛЏКЯЮяФмгы4mol[AgЃЈNH3ЃЉ2]OHЗДгІ
ЂлЦфКЫДХЙВеёЧтЦзЯдЪОга4жжВЛЭЌЛЏбЇЛЗОГЕФЧт
(4)НсКЯЩЯЪіСїГЬжаЕФаХЯЂЃЌаДГівд1ЃЌ4-ЖЁЖўДМЮЊдСЯжЦБИЛЏКЯЮя ЕФКЯГЩТЗЯпЃЈЦфЫћЪдМСШЮбЁЃЉ______ЁЃ
ЕФКЯГЩТЗЯпЃЈЦфЫћЪдМСШЮбЁЃЉ______ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСагаЙиЫЕЗЈВЛе§ШЗЕФЪЧЃЈ ЃЉ
A. ШЫУЧзюдчЯШИљОнЮЖЕРРДЛёЕУЦгЫиЕФЫсЁЂМюИХФюЃКвЛЧагаЫсЮЖЕФЮяжЪЖМЪЧЫсЃЌвЛЧагаЩЌЮЖЕФЮяжЪЖМЪЧМюЁЃ
B. ВЈвхЖњЛљгкжИЪОМСБфЩЋРДЗжБцЫсМюЃКЫсвЛЖЈФмЪЙЪЏШяБфКьЃЌМювЛЖЈФмЪЙЪЏШяБфРЖЁЃ
C. ЕиЧђЩЯзюДѓЙцФЃЕФЛЏбЇЗДгІЪЧжВЮяЕФЙтКЯзїгУЃЌШЫРрРћгУЕЊЗЪЕФзюгааЇЕФЗДгІЪЧКЯГЩАБЗДгІЁЃ
D. ЫсМюжЪзгРэТлЃКЗВЪЧФмИјГі![]() ЕФЮяжЪОЭЪЧЫсЃЌЗВЪЧФмНсКЯ
ЕФЮяжЪОЭЪЧЫсЃЌЗВЪЧФмНсКЯ![]() ЕФЮяжЪОЭЪЧМюЃЌЪЪгУЫЎШмвКЃЌвВЪЪгУЗЧЫЎШмвКЛђЮоЫЎЬѕМўЁЃ
ЕФЮяжЪОЭЪЧМюЃЌЪЪгУЫЎШмвКЃЌвВЪЪгУЗЧЫЎШмвКЛђЮоЫЎЬѕМўЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЪвЮТЯТЃЌгУ0ЃЎ100mol/L NaOH ШмвКЗжБ№ЕЮЖЈ20ЃЎ00mL 0ЃЎ100mol/LЕФбЮЫсКЭДзЫсЃЌЕЮЖЈЧњЯпШчЭМЫљЪОЃЎЯТСаЫЕЗЈе§ШЗЕФЪЧ

A. ЂёЁЂЂђЗжБ№БэЪОбЮЫсКЭДзЫсЕФЕЮЖЈЧњЯп
B. V(NaOH)=10ЃЎ00 mL ЪБ ЃО1
ЃО1
C. pH=7ЪБЃЌСНжжЫсЫљгУNaOHШмвКЕФЬхЛ§ЯрЕШ
D. V(NaOH)=20ЃЎ00 mL ЪБЃЌc(Cl-)ЃМc(CH3COO-)
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЬМКЭЕЊЕФЛЏКЯЮядкЩњВњЁЂЩњЛюжаЙуЗКДцдкЁЃЧыЛиД№ЯТСаЮЪЬтЃК
(1)зЪСЯЯдЪОЃЌПЩгУДЮТШЫсФЦДІРэЗЯЫЎжаЕФАБЕЊ![]() ЃЌЪЙЦфзЊЛЏЮЊЕЊЦјГ§ШЅЁЃЦфжївЊЗДгІШчЯТ
ЃЌЪЙЦфзЊЛЏЮЊЕЊЦјГ§ШЅЁЃЦфжївЊЗДгІШчЯТ
I.![]()
![]()
![]()
![]()
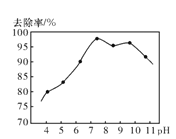
ЂйвдЩЯЗДгІжаHClOЕФРДдДгУЛЏбЇгУгяНтЪЭЪЧ______ЁЃ
ЂкЪЕбщВтЕУЁЃЗЯЫЎжаpHгыАБЕЊШЅГ§ТЪЕФЙиЯЕШчЭМЫљЪОЁЃpHНЯИпЪБЃЌАБЕЊШЅГ§ТЪЯТНЕЕФдвђЪЧ___ЁЃ
(2)МзУИЪЧживЊЕФЛЏЙЄдСЯЃЌгжПЩзїЮЊШМСЯЃЌЙЄвЕЩЯПЩРћгУCOЛђ![]() РДЩњВњШМСЯМзДМЁЃвбжЊжЦБИМзДМЕФгаЙиЗДгІЕФЛЏбЇЗНГЬЪНМАЦфдкВЛЭЌЮТЖШЯТЕФЛЏбЇЦНКтГЃЪ§ШчЯТБэЫљЪОЁЃ
РДЩњВњШМСЯМзДМЁЃвбжЊжЦБИМзДМЕФгаЙиЗДгІЕФЛЏбЇЗНГЬЪНМАЦфдкВЛЭЌЮТЖШЯТЕФЛЏбЇЦНКтГЃЪ§ШчЯТБэЫљЪОЁЃ
ЛЏбЇЗДгІ | ЦНКтГЃЪ§ | ЮТЖШ/Ёц | ||
500 | 700 | 800 | ||
|
|
|
|
|
|
|
|
|
|
|
| |||
ЂйЯТСаДыЪЉФмЪЙЗДгІ![]() ЕФЦНКтЬхЯЕжа
ЕФЦНКтЬхЯЕжа![]() діДѓЕФЪЧ______
діДѓЕФЪЧ______![]() ЬюзжФИДњКХ
ЬюзжФИДњКХ![]() ЁЃ
ЁЃ
A.НЋ![]() ДгЬхЯЕжаЗжРыГіШЅ
ДгЬхЯЕжаЗжРыГіШЅ![]() ГфШы
ГфШы![]() ЃЌЪЙЬхЯЕбЙЧПдіДѓ
ЃЌЪЙЬхЯЕбЙЧПдіДѓ
C.Щ§ИпЮТЖШ![]() КуШнЪБдйГфШы1mol
КуШнЪБдйГфШы1mol![]()
![]()
Ђк500ЁцЪБВтЕУЗДгІ![]() дкФГЪБПЬ
дкФГЪБПЬ![]() ЁЂ
ЁЂ![]() ЁЂ
ЁЂ![]() ЁЂ
ЁЂ![]() ЕФХЈЖШЗжeЮЊ
ЕФХЈЖШЗжeЮЊ![]() ЁЂ
ЁЂ![]() ЁЂ
ЁЂ![]() ЁЂ
ЁЂ![]() ЃЌдђДЫЪБе§
ЃЌдђДЫЪБе§![]() ______
______![]() ЬюЁА
ЬюЁА![]() ЁБЁА
ЁБЁА![]() ЁБЛђЁА
ЁБЛђЁА![]() ЁБ
ЁБ![]() v
v![]() Фц
Фц![]() ЁЃ
ЁЃ
(3)ГЃЮТЯТЃЌдк![]() ШмвКжаЃЌЗДгІ
ШмвКжаЃЌЗДгІ![]() ЕФЛЏбЇЦНКтГЃЪ§
ЕФЛЏбЇЦНКтГЃЪ§![]() ______ЁЃ
______ЁЃ![]() вбжЊЃКГЃЮТЯТЃЌ
вбжЊЃКГЃЮТЯТЃЌ![]() ЕФЕчРыЦНКтГЃЪ§
ЕФЕчРыЦНКтГЃЪ§![]() ЃЌ
ЃЌ![]() ЕФЕчРыКтГЃЪ§
ЕФЕчРыКтГЃЪ§![]() ЁЂ
ЁЂ![]()
(4)ЕчНтЯѕЫсЩЯвЕЕФЮВЦјNOПЩжЦБИ![]() ЃЌЦфЙЄзїдРэШчЭМЫљЪОЃК
ЃЌЦфЙЄзїдРэШчЭМЫљЪОЃК
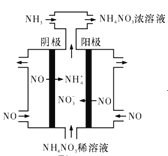
ЂйвѕМЋЕФЕчМЋЗДгІЪНЮЊ______ЁЃ
ЂкНЋЕчНтЩњГЩЕФ![]() ШЋВПзЊЛЏЮЊ
ШЋВПзЊЛЏЮЊ![]() ЃЌдђЭЈШыЕФ
ЃЌдђЭЈШыЕФ![]() гыЪЕМЪВЮМгЗДгІЕФNOЕФЮяжЪЕФСПжЎБШжСЩйЮЊ___ЁЃ
гыЪЕМЪВЮМгЗДгІЕФNOЕФЮяжЪЕФСПжЎБШжСЩйЮЊ___ЁЃ
ВщПДД№АИКЭНтЮі>>
АйЖШжТаХ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com