
【题目】某同学设计了甲烷燃料电池并探究某些工业电解原理(如图所示),其中乙装置为探究氯碱工业原理(X为阳离子交换膜,C为石墨电极),丙装置为探究粗铜精炼原理。请回答下列问题:

(1)从 a口通入的气体为_______。
(2)B电极的电极材料是________。
(3)写出甲中通甲烷一极的电极反应式:________________________________ 。
(4)写出乙中发生的总反应的离子方程式为________________________________。
【答案】氧气 粗铜 CH4 -8e- + 10OH- = CO32-+ 7H2O 2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
【解析】
乙装置为探究氯碱工业原理,说明铁电极为阴极,则b为电源的负极,即通入甲烷,a为电源的正极,通入氧气。丙为电解精炼铜,则A为精铜,B为粗铜。
乙装置为探究氯碱工业原理,说明铁电极为阴极,则b为电源的负极,即通入甲烷,a为电源的正极,通入氧气。丙为电解精炼铜,则A为精铜,B为粗铜。(1)根据分析a极通入的为氧气;
(2)B连接电源的正极,是电解池的阳极,应为粗铜;
(3)根据电解质溶液为氢氧化钾分析,甲烷失去电子生成碳酸根离子,电极反应为CH4 -8e- + 10OH- = CO32-+ 7H2O;
(4)乙为电解氯化钠溶液,电解反应方程式为2Cl-+2H2O![]() Cl2↑+H2↑+2OH-。
Cl2↑+H2↑+2OH-。


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 向0.1 mol·L1的氨水中加少量硫酸铵固体,则溶液中![]() 增大
增大
B. 常温下,0.1 mol·L1一元酸(HA)溶液pH=3,则该溶液中,c2(H+)=c(H+)×c(A)+KW
C. 向含有1 mol KAl(SO4)2的溶液中加入Ba(OH)2溶液得到沉淀的物质的量最多为 2 mol
D. 将Ca(ClO)2、Na2SO3、FeCl3、NaAlO2溶液蒸干均得不到原溶质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用甲烷与氯气发生取代反应的副产品生产盐酸的设想在工业上已成为现实。某化学兴趣小组拟在实验室中模拟上述过程,所设计的装置如下图所示:
(1)A中制取C12反应的化学方程式是_____________________________。
(2)D装置中的石棉上吸附着潮湿的KI粉末,其作用是_________________________。
(3)E装置的作用是______________(填序号)。
A.收集气体B.吸收氯气C.吸收氯化氢
(4)E装置中除了有盐酸生成外,还含有有机物,从E中分离出盐酸的最佳方法是______________。
(5)将lmolCH4与C12发生取代,测得4种有机取代物的物质的量相等,则消耗的氯气的物质的量是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向容积为2 L的密闭容器中加入足量活性炭和NO,发生反应:C(s)+2NO(g)![]() N2(g)+CO2(g),△H<0,NO和N2的物质的量变化如下表所示。
N2(g)+CO2(g),△H<0,NO和N2的物质的量变化如下表所示。
物质的量/mol | T1/℃ | T2/℃ | |||||
0 | 5 min | 10 min | 15 min | 20 min | 25 min | 30 min | |
NO | 2.0 | 1.16 | 0.80 | 0.80 | 0.50 | 0.40 | 0.40 |
N2 | 0 | 0.42 | 0.60 | 0.60 | 0.75 | 0.80 | 0.80 |
请回答下列问题:
(1) 0—5 min内,以CO2表示的该反应速率v(CO2)=____,该条件下的平衡常数K=____。
(2) 第15 min后,温度调整到T2,数据变化如上表所示,则T1___T2(填“>”、“<”或“=” )。
(3)若30 min时,保持T2不变,向该容器中再加入该四种反应混合物各2 mol,则该可逆反应最终达平衡时NO的转化率α=_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0. 1000 mol·L-1的盐酸滴定20.00 mL未知浓度的Na2CO3溶液,溶液的pH与所加盐酸的体积关系如图所示(饱和H2CO3溶液pH=5.6)。下列有关叙述正确的是
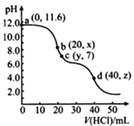
A. 若c(Na2CO3)=0.1000 mol·L-1,则H2CO3的Ka2数量级约为10-6
B. c点处溶液中一定有:c(Na+)=2c(CO32-)+c(HCO3-)
C. a、c两点水的c(OH-)之比为10-11.6 :10-7
D. 若z=5.6,则d点有c(Na+)=c(Cl-)>c(H2CO3)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合题图10 的是

A. CO2(g)+2NH3(g)![]() CO(NH2)2(s)+H2O(g);△H<0
CO(NH2)2(s)+H2O(g);△H<0
B. CO2(g)+H2(g)![]() CO(g)+H2O(g);△H>0
CO(g)+H2O(g);△H>0
C. CH3CH2OH (g)![]() CH2=CH2(g)+H2O(g);△H>0
CH2=CH2(g)+H2O(g);△H>0
D. 2C6H5CH2CH3(g)+O2(g)![]() 2 C6H5CH=CH2(g)+2H2O(g);△H<0
2 C6H5CH=CH2(g)+2H2O(g);△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组进行了下列关于氯化铵的课外实验:
(实验操作)

浸过氯化钠溶液的布条很快烧光,浸过氯化铵溶液的布条不燃烧,冒出白烟。
(1)氯化铵饱和溶液中离子浓度由大到小的顺序是________。白烟的成分是______________。
(2)请推测浸过氯化铵溶液的布条不燃烧、不易着火的主要原因(写出一条即可)__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O![]() Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
A.充电时阳极反应:Ni(OH)2 -e— + OH- = NiOOH + H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将SO2气体分别通入下列四种溶液中,有关现象及结论的说法正确的是
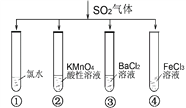
A. 试管①中有淡黄色沉淀生成,说明SO2有氧化性
B. 试管②中溶液褪色,说明SO2有漂白性
C. 试管③中能产生白色沉淀,说明SO2有酸性
D. 试管④中溶液颜色变浅,说明SO2有还原性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com