
| A. | 若2,2,3,3-四甲基戊烷由烯烃加成而来,则该烯烃的名称是2,2,3,3-四甲基-1--戊烯 | |
| B. | 在氯化银的沉淀溶解平衡体系中,加入蒸馏水,氯化银的Ksp增大 | |
| C. | 在氯化银的沉淀溶解平衡体系中,加入碘化钾固体,氯化银沉淀可转化为碘化银沉淀 | |
| D. | 在碳酸钙的沉淀溶解平衡体系中,加入稀盐酸,溶解平衡不移动 |
分析 A.碳碳双键只能在戊烷的4、5号上,则命名烯烃时双键在1、2号C上;
B.Ksp只与温度有关;
C.AgI比AgCl更难溶;
D.盐酸与碳酸根离子反应,促进碳酸钙的溶解.
解答 解:A.若2,2,3,3-四甲基戊烷由烯烃加成而来,则该烯烃的名称是3,3,4,4-四甲基-1--戊烯,故A错误;
B.在氯化银的沉淀溶解平衡体系中,加入蒸馏水,氯化银的Ksp不变,故B错误;
C.在氯化银的沉淀溶解平衡体系中,加入碘化钾固体,因AgI比AgCl更难溶,则氯化银沉淀可转化为碘化银沉淀,故C正确;
D.在碳酸钙的沉淀溶解平衡体系中,加入稀盐酸,盐酸与碳酸根离子反应,促进碳酸钙的溶解,溶解平衡正向移动,故D错误;
故选C.
点评 本题考查难溶电解质的溶解平衡,为高频考点,把握Ksp及沉淀转化、溶解平衡移动等为解答的关键,侧重分析与应用能力的考查,注意沉淀生成与沉淀转化的判断及Ksp只与温度有关,题目难度不大.


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
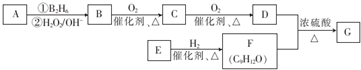
 ;该反应的反应类型为取代反应或酯化反应
;该反应的反应类型为取代反应或酯化反应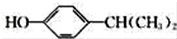 .
.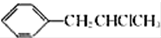 为原料也可合成F,请参考题目中的相关信息写出相应的合成路线图(反应条件中的试剂写在箭头上方,其他写在箭头下方):
为原料也可合成F,请参考题目中的相关信息写出相应的合成路线图(反应条件中的试剂写在箭头上方,其他写在箭头下方):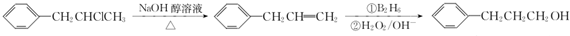 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (g)+CO2(g)?
(g)+CO2(g)?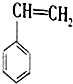 (g)+CO(g)+H2O(g)△H
(g)+CO(g)+H2O(g)△H| 化学键 | C-H | C-C | C=C | C=O | CO | O-H |
| 键能/kJ/mol | 413 | 348 | 615 | 745 | 1076 | 463 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 原子及其离子的核外电子层数等于该元素所在的周期数 | |
| B. | 元素周期表中从IIIB族到IIB族 10个纵行的元素都是金属元素 | |
| C. | 除氦外的稀有气体原子的最外层电子数都是8 | |
| D. | 同一元素的各种同位素的物理性质、化学性质均相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
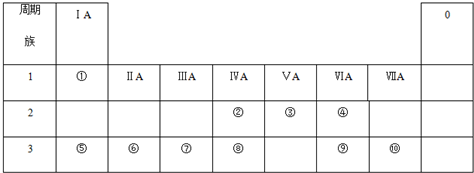
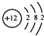
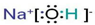
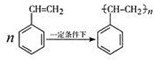
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com