
NA表示阿伏加德罗常数的值,下列说法正确的是( )
|
| A. | 1molCl2参加的任何反应转移电子数都是2NA |
|
| B. | 1mol/L的NaCl溶液中含有NA个Na+ |
|
| C. | 标准状况下,22.4ml水中含有的分子数约为1.24NA |
|
| D. | 1molFeCl3完全水解生成NA个胶体粒子 |
| 阿伏加德罗常数. | |
| 专题: | 阿伏加德罗常数和阿伏加德罗定律. |
| 分析: | A.氯气与氢氧化钠溶液的反应生成氯化钠、次氯酸钠和水,1mol氯气完全反应转移了1mol电子; B.缺少氯化钠溶液的体积,无法计算溶液中钠离子的物质的量; C.22.4mL水的质量约为22.4g,根据n= D.铁离子的水解为可逆反应,且胶体粒子为氢氧化铁的聚集体无法计算溶液中胶粒数目. |
| 解答: | 解:A.1molCl2参加的反应,如果与金属反应,1mol氯气得到2mol电子,但是氯气与氢氧化钠溶液的反应中,氯气既是氧化剂也是还原剂,1mol氯气完全反应转移了1mol电子,所以1mol氯气反应转移电子数不一定为2NA,故A错误; B.没有告诉氯化钠溶液的体积,无法根据n=cV计算出该氯化钠溶液的物质的量,故B错误; C.22.4mL水的质量约为22.4g,水的物质的量为: D.铁离子的水解为可逆反应,1mol氯化铁中,参加水解的生成氢氧化铁的铁离子小于1mol,且氢氧化铁胶体粒子为氢氧化铁聚集体,所以生成的氢氧化铁胶粒一定小于1mol,生成的胶粒数一定小于NA,故D错误; 故选C. |
| 点评: | 本题考查阿伏加德罗常数的综合应用,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系,选项D为易错点,注意氢氧化铁胶粒为氢氧化铁的聚集体. |


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
将Mg、Cu组成的混合物26.4 g,投入到适量的稀硝酸中,固体完全溶解,收集到标准状况下的NO气体8.96 L,向反应后的溶液中加入过量的5mol/L的NaOH溶液300 mL,金属离子完全沉淀。则形成沉淀的质量是:( )
A.32.8g B.46.8g C.53.6g D.63.8g
查看答案和解析>>
科目:高中化学 来源: 题型:
酸雨的主要成分是H2SO4,以下是形成途径之一:①NO2+SO2=NO+SO3,②2NO+O2=2NO2,③SO3+H2O=H2SO4,以下叙述错误的是
A.NO2由反应N2+2O2 2NO2生成
2NO2生成
B.总反应可表示为2SO2+O2+2H2O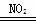 2H2SO4
2H2SO4
C.还可能发生的反应有4NO2+O2+2H2O=4HNO3
D.还可能发生的反应有4NO+3O2+2H2O=4HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组在实验室条件下以硫酸铜溶液为电解液,用电解的方法实现了粗铜(含有少量的锌、铁、银、金等金属和少量矿物杂质)的提纯,并对阳极泥和电解液中金属进行回收和含量测定。请回答以下问题。
(1)电解时,粗铜应与电源的 极相连,阴极上的电极反应式为 ;电解过程中,硫酸铜的浓度会 (选填“变大”“不变”或“变小”)。
(2)电解完成后,该小组同学将电解液过滤后对滤液和阳极泥分别进行处理:
①阳极泥的综合利用:稀硝酸处理阳极泥得到硝酸银稀溶液,请你写出该步反应的离子方程式: 。
②Cu的回收、滤液成分及含量的测定:以下是该小组设计的一个实验流程。
在上述流程中空格内填上相应的操作: 、 ;100 mL滤液中Cu2+的浓度为 mol/l,Fe2+的浓度为 mol/l。
查看答案和解析>>
科目:高中化学 来源: 题型:
锑(Sb)在自然界中一般以硫化物的形式存在,我国锑的蕴藏量占世界第一.从硫化物中提取单质锑一般先在高温下将硫化物转化为氧化物,再用碳还原:关于反应①、②的说法正确的是( )
①2Sb2S3+3O2+6Fe Sb4O6+6FeS,
Sb4O6+6FeS,
②Sb4O6+6C 4Sb+6CO↑.
4Sb+6CO↑.
|
| A. | 反应①、②中的氧化剂分别是Sb2S3、Sb4O6 |
|
| B. | 反应①中每生成3molFeS时,共转移6 mol电子 |
|
| C. | 反应②说明高温下Sb的还原性比C强 |
|
| D. | 每生成4 molSb时,反应①与反应②中还原剂的物质的量之比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
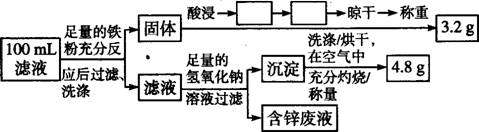
控制适合的条件,将反应Fe3++Ag⇌Fe2++Ag+设计成如图所示的原电池(盐桥装有琼脂﹣硝酸钾溶液;灵敏电流计的0刻度居中,左右均有刻度).已知接通后观察到电流计指针向右偏转.下列判断正确的是( )
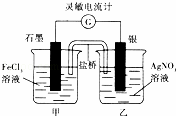
|
| A. | 盐桥中的K+移向乙烧杯 |
|
| B. | 一段时间后,电流计指针反向偏转,越过0刻度,向左边偏转 |
|
| C. | 在外电路中,电子从石墨电极流向银电极 |
|
| D. | 电流计指针居中后,往甲烧杯中加入一定量的铁粉,电流计指针将向左偏转 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:A为常见的短周期轻金属,含A的合金材料常用于火箭、飞机、轮船等制造业;B是一种盐,在工农业生产中用途较广;C、F、H为常见非金属单质;常温下C、F、I、E、J和K为气体;E对空气的相对密度为0.586;G为液体.有关物质间的转化关系如下(图中部分反应物或产物已省略):
请填空
(1)B的电子式 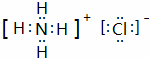 ,B物质的水溶液呈 酸性 ,原因是 NH4++H20⇌NH3.H2O+H+ (用离子方程式表示)
,B物质的水溶液呈 酸性 ,原因是 NH4++H20⇌NH3.H2O+H+ (用离子方程式表示)
(2)反应①的离子反应方程式为 Mg+2NH4+=Mg2++2NH3↑+H2↑
(3)操作a必须在HCl气流中加热得无水物,其原因是 抑制Mg2+的水解 ;操作b为 熔融状态下电解
(4)K+G+F→L写出该反应的化学方程式 4NO2+O2+2H2O=4HNO3 ,
(5)已知C的燃烧热为286KJ/mol,请写出表示1g C在F中完全燃烧生成液体G的热化学反应方程式 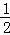 H2(g)+
H2(g)+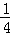 O2(g)=
O2(g)=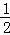 H2O(l)△H=﹣143kJ/mol .
H2O(l)△H=﹣143kJ/mol .
查看答案和解析>>
科目:高中化学 来源: 题型:
在1L恒容密闭容器中充入1mol Z发生反应:2Z(g)═2X(g)+Y(g),反应过程持续升高温度,测得混合体系中Z的体积分数与温度的关系如图所示.下列推断正确的是( )

|
| A. | 升高温度,平衡常数减小 |
|
| B. | Z在a、c两点的反应速率相等 |
|
| C. | b点时,Z的转化率最小 |
|
| D. | 平衡时充入惰性气体时,平衡向逆反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是实验室制溴苯的装置图,下列说法正确的是( )
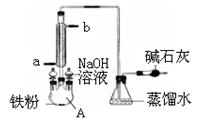
A.左侧的分液漏斗中加入的是苯和溴水
B.仪器A的名称叫蒸馏烧瓶
C.锥形瓶中的导管口出现大量白雾
D.碱石灰作用是防止空气中水蒸气进入反应体系
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com