
| A. | N2和O2 | B. | H2和Cl2 | C. | H2和O2 | D. | NO和O2 |
科目:高中化学 来源: 题型:选择题
| A. | 广泛PH试纸可测定某溶液的PH值为13 | |
| B. | 将PH试纸湿润后,测得的PH值一定有误差 | |
| C. | 用PH试纸蘸取溶液,过半分钟与标准比色卡对比 | |
| D. | 精密pH试纸,测得的PH值一定不能为7.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
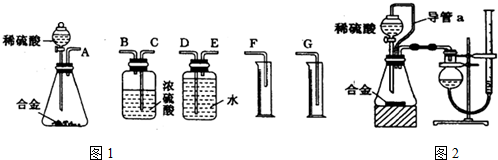
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
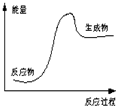
| A. | 该反应为吸热反应 | |
| B. | 该图可以表示石灰石高温分解 | |
| C. | 反应物比生成物稳定 | |
| D. | 因为生成物的总能量高于反应物的总能量,所以该反应一定需要加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在 2 min 内的反应速率,用 C 表示是 0.4 mol/(L•min) | |
| B. | 分别用 B、C、D 表示化学反应速率其比值是 3:2:1 | |
| C. | 达到化学反应限度时,B 物质转化率为 100% | |
| D. | 向容器中增加 A 的投量,可以加快该反应的速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
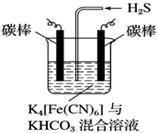 铁及其化合物在工农业生产、环境保护等领域中有着重要的作用.
铁及其化合物在工农业生产、环境保护等领域中有着重要的作用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单烯烃和环烷烃互为同分异构体 | |
| B. | 分子式相差一个或多个“CH2”的有机物一定互为同系物 | |
| C. | 单烯烃的通式是CnH2n,则二烯烃的通式为CnH2n-2 | |
| D. | n>2时,CnH2n+2的同分异构体比CnH2n的同分异构体多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 晶体 | NaCl | KCl | CaO |
| 晶格能/(kJ•mol-1) | 786 | 715 | 3 401 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
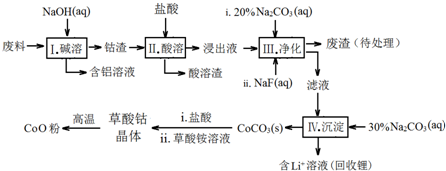
| Fe3+ | Co2+ | Co3+ | Al3+ | |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
| 温度范围/℃ | 固体质量/g |
| 150~210 | 4.41 |
| 290~320 | 2.41 |
| 890~920 | 2.25 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com