
【题目】根据下图及描述,回答下列问题:
(1)关闭图A装置中的止水夹a后,从长颈漏斗向试管中注入一定量的水,静置后如图所示.试判断:A装置是否漏气?(填“漏气”、“不漏气”或“无法确定”) , 判断理由: .
(2)关闭图B装置中的止水夹a后,开启活塞b,水不断往下滴,直至全部流入烧瓶.试判断:B装置是否漏气?(填“漏气”、“不漏气”或“无法确定”) , 判断理由: . 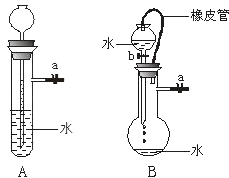
【答案】
(1)不漏气;由于不漏气,加水后试管内气体体积减小,导致压强增大,长颈漏斗内的水面高出试管内的水面.
(2)无法确定;由于分液漏斗和烧瓶间有橡皮管相连,使分液漏斗中液面上方和烧瓶中液面上方的压强相同,无论装置是否漏气,都不影响分液漏斗中的液体滴入烧瓶.
【解析】解:(1)关闭图A装置中的止水夹a后,从长颈漏斗向试管中注入一定量的水,当长颈漏斗下口浸没水中,试管中的气体形成密闭体系.继续加水,试管内液面上升,导致压强增大,长颈漏斗中液面高出试管内液面.静置后,若液面差不变,则气密性良好.故答案为:不漏气; 由于不漏气,加水后试管内气体体积减小,导致压强增大,长颈漏斗内的水面高出试管内的水面;(2)由于分液漏斗和烧瓶间有橡皮管相连,使分液漏斗中液面上方和烧瓶中液面上方的压强相同,无论装置是否漏气,都不影响分液漏斗中的液体滴入烧瓶,如检查是否漏气,应用止水夹夹住橡皮管,再观察分液漏斗中的液体是否能滴入烧瓶,如不能滴入,则说明不漏气.
故答案为:无法确定
由于分液漏斗和烧瓶间有橡皮管相连,使分液漏斗中液面上方和烧瓶中液面上方的压强相同,无论装置是否漏气,都不影响分液漏斗中的液体滴入烧瓶.
检查装置的气密性原理通常是想办法造成装置不同部位有压强差,并产生某种明显现象,如气泡的生成,水柱生成,液面升降.


科目:高中化学 来源: 题型:
【题目】下列事实与氢键有关的是( )
A.水加热到很高的温度都难以分解
B.水结成冰体积膨胀,密度变小
C.CH4、SiH4、SnH4熔点随相对分子质量增大而升高
D.HF、HCl、HBr、HI的热稳定性依次减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是
A. 如果存放有钠、电石等危险化学品的仓库着火,消防员不能用水灭火,应用泡沫灭火器灭火
B. 用石英制成光导纤维,由水玻璃制硅胶都是化学变化
C. 利用油脂在碱性条件下的水解,可以制得肥皂和甘油
D. 糖类、油脂、蛋白质都是高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 1 mol任何气体的体积都是22.4 L
B. 1 mol H2的质量是1 g,它所占的体积是22.4 L
C. 在标准状况下,1 mol任何物质所占的体积都约是22.4 L
D. 在标准状况下,1 mol任何气体所占的体积都约是22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏伽德罗常数,下列叙述正确的是( )
A.0.5 mol Al与足量盐酸反应转移电子数为NA
B.标准状况下,22.4 L氨气与22.4 L氮气所含原子数均为2 NA
C.7.8gNa2O2所含的离子数为0.3NA
D.11.2LCl2完全溶于NaOH溶液,电子转移数为0.5 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学方程式能用离子方程式2H++CO32-=H2O+CO2↑表示的是
A. HCl+NaHCO3=NaCl+H2O+CO2↑
B. 2HCl+BaCO3=BaCl2+H2O+CO2↑
C. H2SO4+Na2CO3=Na2SO4++H2O+CO2↑
D. H2SO3+K2CO3=K2SO3+H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于各图的说法,正确的是( ) 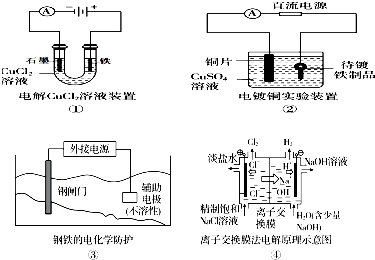
A.①中阳极处能产生使湿润淀粉KI试纸变蓝的气体
B.②中待镀铁制品应与电源正极相连
C.③中钢闸门应与外接电源的正极相连,称为牺牲阳极的阴极保护法
D.④中的离子交换膜可以避免生成的Cl2与NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验. 实验I:反应产物的定性探究,按如图装置(固定装置已略去)进行实验: 
(1)F装置的烧杯中发生反应的离子方程式是;B装置中的现象是 .
(2)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是
(3)实验结束时,撤去所有酒精灯之前必须完成的实验操作是
(4)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是 实验Ⅱ:反应产物的定量探究
(5)在铜与浓硫酸反应的过程中,发现有黑色物质出现,且黑色物质为Cu2S.产生Cu2S的反应为aCu+bH2SO4 ![]() cCu2S+dCuSO4+e H2O,则a:b= .
cCu2S+dCuSO4+e H2O,则a:b= .
(6)为测定硫酸铜的产率,将该反应所得溶液中和后配制成250.00mL溶液,取该溶液25.00mL加入足量KI溶液中振荡,以淀粉溶液为指示剂,用O.36molL﹣1的Na2S2O3溶液滴定生成的I2 , 3次实验平均消耗该Na2S2O3溶液25.00mL.若反应消耗铜的质量为6.4g,则硫酸铜的产率为 . (已知2Cu2++4I﹣=2CuI+I2 , 2S2O32﹣+I2=S4O62﹣+2I﹣)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com