
【题目】中国传统文化中包括许多科技知识。下列古语中不涉及化学变化的是( )
A.熬胆矾(CuSO4·5H2O)铁釜,久之亦化为铜B.千淘万漉虽辛苦,吹尽狂沙始到金
C.凡石灰(CaCO3)经火焚炼为用D.丹砂(HgS)烧之成水银,积变又成丹砂
科目:高中化学 来源: 题型:
【题目】如图所示,其中甲池的总反应式为2CH3OH+3O2+4KOH=2K2CO3+6H2O,下列说法正确的是( )

A.甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置
B.甲池通入CH3OH的电极反应式为CH3OH-6e-+2H2O=CO32-+8H+
C.反应一段时间后,向乙池中加入一定量Cu(OH)2固体能使CuSO4溶液恢复到原浓度
D.甲池中消耗280mL(标准状况下)O2,此时丙池中理论上最多产生1.45g固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)熔融盐燃料电池具有高的发电效率,因而受到重视。可用熔融的碳酸盐作为电解质,向负极充入燃料气CH4,用空气与CO2的混合气作为正极的助燃气,以石墨为电极材料,制得燃料电池。工作过程中,CO![]() 移向________极(填“正”或“负”),已知CH4发生反应的电极反应式为_____________________________,则另一极的电极反应式为___________________________ 。
移向________极(填“正”或“负”),已知CH4发生反应的电极反应式为_____________________________,则另一极的电极反应式为___________________________ 。
(2)某实验小组同学对电化学原理进行了一系列探究活动。
1)如图为某实验小组设计的原电池装置,反应前,电极质量相等,一段时间后,两电极质量相差12 g,导线中通过________mol电子。

2)如图其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,如图所示,

一段时间后,在甲装置铜丝附近滴加酚酞试液,现象是________________,电极反应为________________________;乙装置中石墨(1)为________极(填“正”“负”“阴”或“阳”),乙装置中与铜丝相连石墨(2)电极上发生的反应式为________________,产物常用________检验。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了更简便地制取干燥的NH3,下列方法中适合的是
A.NH4Cl与浓H2SO4混合共热,生成的气体用碱石灰进行干燥
B.N2+3H2![]() 2NH3,用烧碱进行干燥
2NH3,用烧碱进行干燥
C.加热浓氨水,气体用碱石灰干燥
D.加热NH4HCO3,气体用P2O5干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨是人类科学技术发展史上的一项重大突破,研究表明液氨是一种良好的储氢物质。
(1)氨气分解反应的热化学方程式如下:2NH3(g)![]() N2(g)+3H2(g) △H。若:N
N2(g)+3H2(g) △H。若:N![]() N键、H—H键和N—H键的键能值分别记作a、b和c(单位:kJmol-1)则上述反应的△H=______________(用含a、b、c的代数式表示)kJmol-1。
N键、H—H键和N—H键的键能值分别记作a、b和c(单位:kJmol-1)则上述反应的△H=______________(用含a、b、c的代数式表示)kJmol-1。
(2)研究表明金属催化剂可加速氨气的分解。某温度下,用等质量的不同金属分别催化等浓度的氨气,测得氨气分解生成氢气的初始速率(单位:mmolmin-1)与催化剂的对应关系如表所示。
催化剂 | Ru | Rh | Ni | Pt | Pd | Fe |
初始速率 | 7.9 | 4.0 | 3.0 | 2.2 | 1.8 | 0.5 |
①在不同催化剂的催化作用下,氨气分解反应的活化能最大的是______________(填写催化剂的化学式)。
②温度为T时,在恒容的密闭容器中加入2molNH3,此时压强为po,用Ru催化氨气分解,若平衡时氨气的转化率为50%,则该温度下反应2NH3(g)![]() N2(g)+3H2(g)的化学平衡常数Kp=______________。(用平衡分压代替平衡浓度计算,气体分压p分=气体总压P总×体积分数)
N2(g)+3H2(g)的化学平衡常数Kp=______________。(用平衡分压代替平衡浓度计算,气体分压p分=气体总压P总×体积分数)
(3)关于合成氨工艺的理解,下列说法不正确的是______________(填字母)。
A.合成氨工业常采用的反应温度为500℃左右,主要是为了节约能源
B.使用初始反应速率更快的催化剂Ru,不能提高平衡时NH3的产率
C.合成氨工业采用的压强为10MPa~30MPa,是因为常压下N2和H2的转化率不高
(4)在1L1molL-1盐酸中缓缓通入2mol氨气,请在图1中画出溶液中水电离出的OH一浓度随通入氨气的物质的量变化的趋势图。_____________
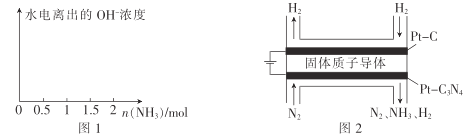
(5)电化学法合成氨:图2是用低温固体质子导体作电解质,用Pt—C3N4作阴极,催化电解H2(g)和N2(g)合成NH3的原理示意图。
①Pt—C3N4电极上产生NH3的电极反应式为______________ 。
②实验研究表明,当外加电压超过一定值后,发现阴极产物中氨气的体积分数随着电压的增大而减小,分析其可能原因:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对硝基甲苯(![]() )是医药、染料等工业的一种重要有机中间体,一种制备对硝基甲苯的实验步骤如下:
)是医药、染料等工业的一种重要有机中间体,一种制备对硝基甲苯的实验步骤如下:
步骤1:向三颈烧瓶中加入甲苯(液态),以发烟硝酸为硝化剂,固体NaHSO4为催化剂(可循环使用),以CCl4为溶剂,乙酸酐为脱水剂(与水反应生成乙酸),45℃下搅拌、回流1h。实验装置如图所示(加热和仪器固定装置均已略去)。

步骤2反应结束后,过滤,滤液分别用5%NaHCO3溶液、水洗至中性。
步骤3:所得液体再经分离提纯得到对硝基甲苯。
(1)装置中,冷却水应从______________(填“a”或“b”)口通入。
(2)反应须控制在45℃下进行的原因是______________。
(3)步骤2中,过滤所得滤渣是______________(填化学式);对滤液进行洗涤可用下列装置中的______________(填字母)。

(4)表中所给出了催化剂种类及用量对甲苯硝化反应影响的实验结果。
催化剂 | n(催化剂) | 硝化产物中各种异构体质量分数(%) | 总产率(%) | ||
n(甲苯) | 对硝基甲苯 | 邻硝基甲苯 | 间硝基甲苯 | ||
浓H2SO4 | 1.0 | 35.6 | 60.2 | 4.2 | 98.0 |
1.2 | 36.5 | 59.5 | 4.0 | 99.8 | |
NaHSO4 | 0.15 | 44.6 | 55.l | 0.3 | 98.9 |
0.25 | 46.3 | 52.8 | 0.9 | 99.9 | |
0.32 | 47.9 | 51.8 | 0.3 | 99.9 | |
0.36 | 45.2 | 54.2 | 0.6 | 99.9 | |
已知:对硝基甲苯、邻硝基甲苯和间硝基甲苯的沸点分别为238.5℃、222℃和230.5℃。
①NaHSO4催化制备对硝基甲苯时,催化剂与甲苯的最佳物质的量之比为______________,
②与浓硫酸作催化剂相比,NaHSO4作催化剂的优点有______________、______________。
③步骤3中,从三种异构体的混合物中分离出对硝基甲苯的方法为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1.92g铜粉与一定量的浓硝酸反应,当铜粉完全作用时收集到气体1.12L(标准状况下),则消耗硝酸的物质的量是
A.0.12molB.0.09molC.0.11molD.0.08mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知苯甲酸的酸性比碳酸强,苯酚的酸性比碳酸弱。则可以将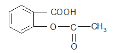 变为
变为![]() 的方法是
的方法是
①与足量的NaOH溶液共热,再通入CO2
②与稀硫酸共热后,加入足量的NaOH溶液
③与稀H2SO4共热后,加入足量的 NaHCO3
④与稀H2SO4共热后,加入足量的Na2CO3
A.①③B.①②C.①④D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A、B、C、D有如下转化关系。回答下列问题:
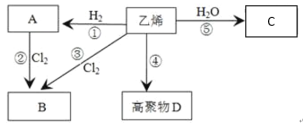
(1)乙烯的电子式为_______,分子中含有的共价键类型有_______(填极性键或非极性键)。
(2)写出下列反应的化学方程式和有机反应类型:
反应④_______,反应类型:________;反应⑤________,反应类型:________。
(3)反应②和反应③都可以用来制备物质B,反应②的条件为_________。
(4)某单烯烃通过加成反应得到的某烷烃的相对分子质量为86,则该烯烃的分子式为____,该烷烃存在多种同分异构体,请写出只能由一种烯烃加成得到的烷烃的结构简式:_______,并用系统命名法命名:_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com